
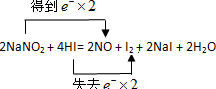
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、276.7 kJ |
| B、160 kJ |
| C、130 kJ |
| D、76.7 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:
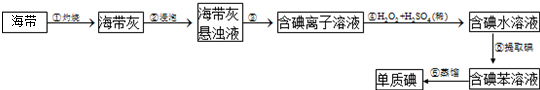
查看答案和解析>>
科目:高中化学 来源: 题型:
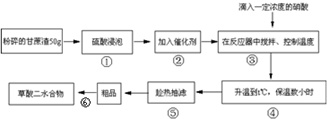
| 硫酸质量分数% | 草酸收率% | 甘蔗渣浸泡后现象 |
| 60 | 36.0 | 甘蔗呈糖浆状,大量为固体 |
| 65 | 60.3 | 大量呈糖浆状,少量为固体 |
| 70 | 72.1 | 呈糖浆状,色棕红 |
| 75 | 70.0 | 呈糖浆状,色棕黑 |
| 80 | 58.0 | 呈糖浆状,有部分炭化色发黑 |
| 浸泡时间/小时 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 草酸收率% | 52.1 | 61.6 | 72.1 | 71.5 | 71.9 | 72.0 | 71.7 |
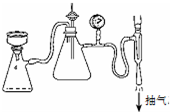 步骤⑥采用的操作方法是:
步骤⑥采用的操作方法是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com