
【题目】根据问题填空:
(1)现有如下A、B两反应: A:2NaOH+H2SO4=Na2SO4+2H2O,B:Zn+H2SO4=ZnSO4+H2↑;
则A,B反应能设计成为原电池的是(填“A”或“B”).
(2)某原电池示意图如图1,则该电池负极电极的反应方程式为 . 
(3)若该电池反应过程中共有0.3mol电子发生转移,则生成的H2在标准状况下的体积是L.
(4)为了研究Fe与稀H2SO4反应的速率,某同学通过如图2实验装置测定反应中生成的H2体积,绘制了如图3所示的曲线,在该实验过程中发现锥形瓶温度升高.请回答以下问题. 
在0~t1、t1~t2、t2~t3各个时间段里,反应速率最大的时间段是 , 产生这种情况可能的原因是;该实验过程中收集到气体最多的是在时间内.
(5)为了减缓该反应的速率,你认为可行的方法是 .
A.向H2SO4溶液中加蒸馏水
B.将Fe片改成Fe粉
C.向H2SO4溶液中加Na2SO4溶液
D.向H2SO4溶液中滴入几滴CuSO4溶液.
【答案】
(1)A
(2)Fe﹣2e﹣=Fe2+
(3)3.36
(4)t1~t2;该反应为放热反应,反应一段时间后,溶液的温度升高,使得反应速率加快;t1~t2
(5)AC
【解析】解:(1)原电池反应必须是自发进行的放热的氧化还原反应,Zn+H2SO4=ZnSO4+H2↑符合,但是A不是氧化还原反应,故选:A;(2)Cu、Fe、硫酸构成的原电池,活泼金属铁是负极,发生失电子的氧化反应:Fe﹣2e﹣=Fe2+ , 所以答案是:Fe﹣2e﹣=Fe2+;(3)根据原电池的正极反应式H++2e﹣=H2↑,过程中共有0.3mol电子发生转移,则生成的H2式0.15mol,标准状况下的体积是3.36L,所以答案是:3.36L.(4)曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,根据图象知,斜率最大的是t1~t2 , 反应的化学反应速率最快,该反应是放热反应,放出的热量使溶液温度升高,升高温度,反应速率加快,收集到的气体最多的是体积之差最大的,即产生气体体积最大的是t1~t2时间段,所以答案是:t1~t2;该反应为放热反应,反应一段时间后,溶液的温度升高,使得反应速率加快;t1~t2;(2)降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快,故选AC.


科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型示意图.下列说法正确的是( ) 
A.甲能使酸性KMnO4溶液褪色
B.乙可与溴水发生取代反应使溴水褪色
C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键
D.丁在稀硫酸作用下可与乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 恒压,通入稀有气体,反应速率不变
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是cl、c2,则时间间隔t1t2内,SO2(g)消耗的平均速率为 v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. AgBr淡黄色难溶于水,可用于制作感光材料
B. SiO2熔点高硬度大,可用于制光导纤维
C. Al2O3是两性氧化物,可用作耐高温材料
D. NH3沸点高易液化,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
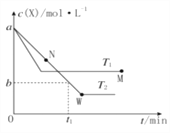
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2 下,在 0t1时间内,v(Y)= ![]() mol·L-1·min-1
mol·L-1·min-1
C. M点的正反应速率v 正大于N点的逆反应速率v逆
D. M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠用于原子反应堆的导热剂,也用于冶炼某些金属。下列说法正确的是 ( )
A. 钠非常活泼,通常保存在水中 B. 钠离子具有强还原性
C. 钠与酒精剧烈反应,浮在酒精上,熔化成小球 D. 钠具有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装罝,回答下列问题:

(1)装置B中Cu上发生的电极反应方程式为__________________________;电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
b.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、 Cl-几乎都不移动
(2)装置A中总反应的离子方程式为________________________。
(3)若装置E的目的是在Cu材料上镀银,则X为___________,极板N的材料为___________;若装置E的目的是电解精炼铜,则极板___________(填“M”或“N”)的材料为粗铜板(含少量锌、金和银),该电极发生的电极反应式为___________。
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为_______L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com