
| W | X | Y | Z |
| 单质是淡黄色固体 | 与W同周期,其单质常用作半导体材料 | 原子最外层电子数是电子总数的$\frac{2}{3}$ | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 简单离子半径:Z>W | |
| D. | 工业上用Y单质还原Z的氧化物得Z的单质 |
分析 W、X、Y、Z是短周期元素,由W的单质是淡黄色固体,可知W为S元素;X与W同周期,其单质常用作半导体材料,X为Si元素;Y原子最外层电子数是电子总数的$\frac{2}{3}$,若2个电子层,Y的最外层电子为x,则(2+x)×$\frac{2}{3}$=x,解得x=4,则Y为C元素;Z为第三周期原子半径最小的金属元素,则Z为Al元素,以此来解答.
解答 解:由上述分析可知,W为S,X为Si,Y为C,Z为Al,
A.非金属性越强,对应氢化物越稳定,则气态氢化物的热稳定性:X<W,故A错误;
B.非金属性Y>X,则最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.电子层越多,离子半径越大,则简单离子半径:W>Z,故C错误;
D.氧化铝熔点高,不能用Y单质还原Z的氧化物得Z的单质,应选电解法得到Z的单质,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识与规律性知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 实现无氰电镀 | B. | 研制可降解塑料 | C. | 使用无铅汽油 | D. | 使用无氟冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
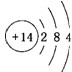 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据实验装置图回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 方法 | 结论 |
| A | 实验室制氢气,向稀H2SO4中滴加少量Cu(NO3)2溶液 | 可以加快制备氢气的反应速率 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行 | 则该反应的△S<0 |
| D | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
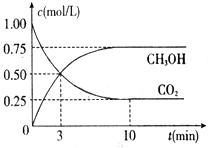
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 | |
| B. | 由于燃烧反应放热,所以△H1和△H2均取正值 | |
| C. | 由于石墨和金刚石同为碳元素组成,所以△H1=△H2 | |
| D. | 由于燃烧均为放热反应,所以石墨为重要的能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
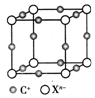 前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com