
| A. | 常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大 | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b | |
| C. | 若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| D. | 常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw |
分析 A.Ag+、Cl-都抑制AgCl溶解;
B.常温下pH=3的醋酸浓度大于pH=11的NaOH浓度,二者等体积混合后溶液中溶质为醋酸和醋酸钠,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;
等物质的量浓度的HCl和NaOH溶液等体积混合,二者恰好完全反应生成NaCl,溶液呈中性,
酸或碱抑制水电离;
C.若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则存在c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),则c(Na+)=2c(CO32-)+c(HCO3-);
D.常温下,醋酸电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$、醋酸根水解平衡常数Kh=$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,离子积常数Kw=c(H+).c(OH-).
解答 解:A.Ag+、Cl-都抑制AgCl溶解,常温下,物质的量浓度相同的硝酸银和氯化钠溶液其抑制AgCl溶解程度相等,所以AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度相同,故A错误;
B.常温下pH=3的醋酸浓度大于pH=11的NaOH浓度,二者等体积混合后溶液中溶质为醋酸和醋酸钠,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;
等物质的量浓度的HCl和NaOH溶液等体积混合,二者恰好完全反应生成NaCl,溶液呈中性,
酸或碱抑制水电离,所以前者抑制水电离,则水的电离程度:a<b,故B错误;
C.若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则存在c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-),则c(Na+)=2c(CO32-)+c(HCO3-)=0.2mol/L,故C错误;
D.常温下,醋酸电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$、醋酸根水解平衡常数Kh=$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$,离子积常数Kw=c(H+).c(OH-),则Ka.Kh=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$.$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=c(H+).c(OH-)=Kw,故D正确;
故选D.
点评 本题考查难溶物溶解平衡、离子浓度大小比较、酸碱混合溶液定性判断等知识点,侧重考查学生分析判断能力,明确溶液中存在溶质及其性质、电荷守恒是解本题关键,难点是D选项,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1.36×10-5 mol•L-1 | B. | 8.90×10-6 mol•L-1 | ||
| C. | 4.45×10-2 mol•L-1 | D. | 1×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
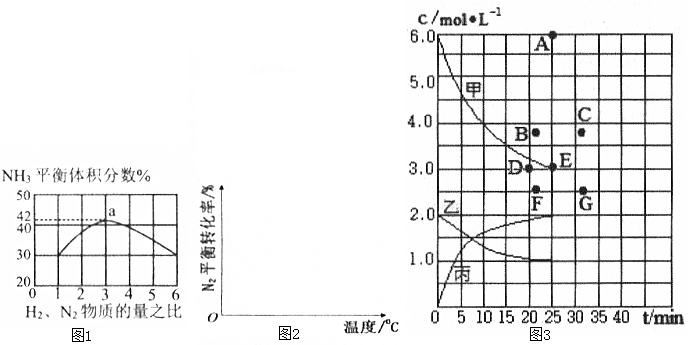

| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
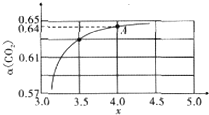 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112mL | B. | 224mL | C. | 118.72 mL | D. | 201.6 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
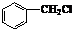
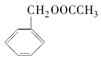 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: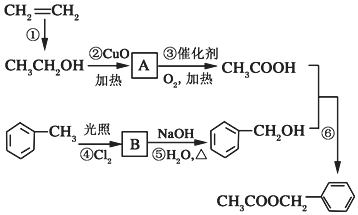
 ;
;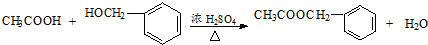 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com