
【题目】在标准状况下有:① 6.72 L CH4,② 3.01×1023个HCl分子,③ 13.6 g H2S,④ 0.2 mol NH3。下列对这四种气体的描述正确的是( )
A.体积②>③>①>④B.密度 ②<③<④<①
C.质量②>③>④>①D.氢原子个数 ①<③<④<②
【答案】A
【解析】
根据n=![]() 计算CH4的物质的量,根据n=
计算CH4的物质的量,根据n=![]() 计算HCl的物质的量,根据n=
计算HCl的物质的量,根据n=![]() 计算H2S的物质的量。相同条件下,体积之比等于物质的量之比,密度之比等于摩尔质量之比;根据m=nM计算甲烷、HCl、氨气的质量;根据各分子含有的H原子数目,计算各物质含有的H原子物质的量,据此判断。
计算H2S的物质的量。相同条件下,体积之比等于物质的量之比,密度之比等于摩尔质量之比;根据m=nM计算甲烷、HCl、氨气的质量;根据各分子含有的H原子数目,计算各物质含有的H原子物质的量,据此判断。
①6.72LCH4的物质的量n=![]() =
=![]() =0.3mol,
=0.3mol,
②3.01×1023个HCl的物质的量n=![]() =
=![]() =0.5mol,
=0.5mol,
③13.6gH2S的物质的量n=![]() =
=![]() =0.4mol,
=0.4mol,
④0.2molNH3;
A.相同条件下体积之比等于物质的量之比,故体积②>③>①>④,故A正确;
B.相同条件下,密度之比等于摩尔质量之比,故密度②>③>④>①,故B错误;
C.根据m=nM知,甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量②>③>①>④,故C错误;
D.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目①>③>④>②,故D错误;
故答案选A。


科目:高中化学 来源: 题型:
【题目】我国化学家合成的铬的化合物,通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现岀较好的催化活性。合成铭的化合物过程中一步反应如下,该反应涉及H、C、N、O、Cl、Cr等多种元素。
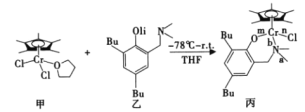
回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是_____________(填标号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)化合物乙中碳原子采取的杂化方式为______,化合物丙中a、b、n、m处的化学键是配位键的是______(填字母)处。
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为______;已知没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子为无颜色的是______(填离子符号)。
(4)ClO3-的键角小于ClO4-的键角,原因是______。
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:______。
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为_____晶胞边长为a pm,则重冰的密度为 ____g·cm-3(写出数学表达式,NA为阿伏伽徳罗常数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化碳酰胺[CO(NH2)2H2O2]是一种高效、安全的固体消毒剂,白色晶体,易溶于水,稍高温度时可发生分解。某化学小组欲制备少量过氧化碳酰胺,并测定其活性氧的含量,回答下列问题。
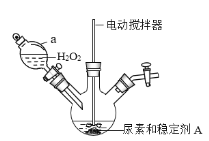
(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是________。
(2)该反应的最佳温度为35℃,采用的合适加热方式为________。
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10molL-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式____________。
(2)过氧化碳酰胺中活性氧含量为_____%。若配制过氧化碳酰胺溶液定容时俯视刻度线,则测得过氧化碳酰胺中活性氧含量______(填“偏高”“偏低”或“无影响”)。
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为________,理由是_____________。
稳定剂名称 | 过氧化碳酰胺活性氧的含量/10-2 | ||||
初始数 | 室温储存30天后数 | 减少量 | 热储存保温1天后数 | 减少量 | |
EDTA | 16.96 | 16.87 | 0.09 | 16.92 | 0.04 |
柠檬酸 | 16.94 | 16.90 | 0.04 | 16.91 | 0.03 |
EDTA与柠檬酸混合物 | 16.95 | 16.90 | 0.05 | 16.90 | 0.05 |
柠檬酸与焦磷酸钠混合物 | 16.90 | 16.86 | 0.04 | 16.87 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,同质量的X、Y两种气体,相对分子质量分别为A、B;则:
(1)X与Y的体积比为_______,分子个数比为 _______,密度比为________;
(2)相同条件下的X、Y两种气体体积相同,则X与Y的质量比为_______,物质的量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,32 g氧气的体积约为22.4L
B.1.8 g NH4+中含有的质子数为NA
C.常温常压下,48g O3含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,浓度均为1mol·L-1的CH3NH2和NH2OH两种碱溶液,起始时的体积都为10mL。分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lg[c(OH-)]。下列说法正确的是( )
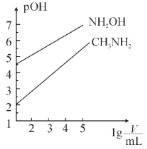
A.当两溶液均稀释至lg![]() =5时,溶液中水的电离程度:NH2OH<CH3NH2
=5时,溶液中水的电离程度:NH2OH<CH3NH2
B.常温下,用盐酸滴定NH2OH时,可用酚酞作指示剂
C.CH3NH3Cl溶液中存在关系:2c(H+)+c(CH3NH)=c(CH3NH2)+2c(OH-)+c(Cl-)
D.等浓度的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系为:c(NH3OH+)>c(CH3NH+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的容器中进行反应N2(g)+3H2(g) ![]() 2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
2NH3(g),若氮气浓度由0.1 mol·L-1降到0.06 mol·L-1需2 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为
A. 等于1.8 s B. 等于1.2 s C. 大于1.8 s D. 小于1.8 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为某研究性学习小组探究金属腐蚀条件的实验装置图,试分析实验并回答下列问题:
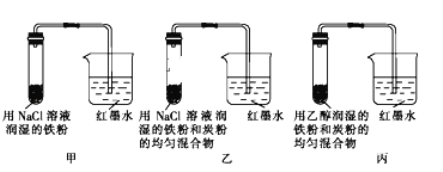
(1)起始时若甲、乙、丙三套装置的导管中液面高度相同,则过一段时间后导管中液面最高的是_____(填装置代号).
(2)通过甲、乙装置的对比实验说明,钢铁中碳的含量越_____(填“高”或“低”)越容易被腐蚀.
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_____.
(4)为防止铁的锈蚀,工业上普遍采用的方法是_____(写出一点即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20.00mL0.1000mol·L-1的醋酸溶液中逐滴加入0.1000mol·L-1的NaOH 溶液,测得混合溶液的温度变化如图。下列相关说法正确的是
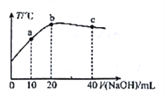
A. 若a点溶液呈酸性,此时:c(CH3COO-) -c(CH3COOH) =2c (H+)-2c(OH-)
B. 从a到b:![]() 逐渐增大
逐渐增大
C. 水的电离程度: b点<c点
D. 溶液的pH 值: a 点<c点<b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com