
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、移液、洗涤、定容,据此排序;
(3)①依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据稀释前后,溶质的物质的量不变计算需要浓硫酸体积;
②依据浓硫酸体积选择量筒规格,依据C=$\frac{n}{V}$进行误差分析;
③根据浓硫酸的密度比水的大,且易溶于水,溶于水时放出大量的热,结合浓硫酸的稀释方法、注意事项解答,依据C=$\frac{n}{V}$进行误差分析;
④在转入容量瓶前烧杯中液体应进行冷却,如果趁热定容,冷却后液面下降,溶液体积偏小,不洗涤导致溶质部分损耗,溶质的物质的量偏小,依据C=$\frac{n}{V}$进行误差分析;
⑤俯视导致溶液体积偏小,仰视导致溶液体积偏大,依据依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)配制浓度为0.5mol•L-1的稀硫酸500ml,一般步骤为:计算、量取、稀释、移液、洗涤、定容,用到的仪器:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的仪器:500mL容量瓶、胶头滴管;
故答案为:量筒;烧杯、玻璃棒、500mL容量瓶、胶头滴管;
(2)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、移液、洗涤、定容,所以正确的顺序为:AEFDCB;
故答案为:AEFDCB;
(3)①98%的浓硫酸(ρ=1.84g•cm-3)的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释规律得:V×18.4mol/L=0.5mol•L-1×500mL,解得V=13.6mL;
故答案为:13.6;
②量取13.6mL浓硫酸,需要用15mL量筒,用水洗净量筒后将洗液一起转移至容量瓶,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液浓度偏高;
故答案为:15;偏高;
③稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;若搅拌过程中有液体溅出结果会使浓度偏,导致溶质的物质的量偏小,溶液浓度偏低;
故答案为:使热量及时的扩散;低;
④在转入容量瓶前烧杯中液体应进行冷却,如果趁热定容,冷却后液面下降,溶液体积偏小,溶液浓度偏高;
不洗涤导致溶质部分损耗,溶质的物质的量偏小,导致溶液浓度偏低;
故答案为:进行冷却;高;低;
⑤俯视导致溶液体积偏小,溶液浓度偏高;仰视导致溶液体积偏大,溶液浓度偏低;
故答案为:偏高;偏低;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意误差分析的方法和技巧.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
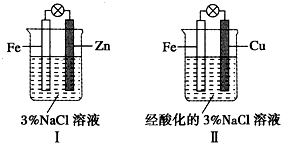
| A. | Ⅰ是验证牺牲阳极的阴极保护法的实验装置 | |
| B. | Ⅰ和Ⅱ中负极反应式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
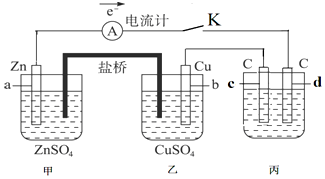
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
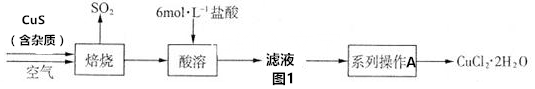

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
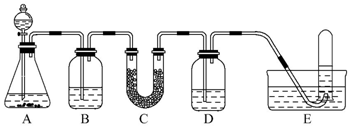
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com