
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH═CHR2,被氧化为![]() 和
和![]() ;
; 被氧化为
被氧化为 和
和 ,由此推断分子式为C5H10的烯烃的氧化产物有( )
,由此推断分子式为C5H10的烯烃的氧化产物有( )
A.5种 B.6种 C.7种 D.8种
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E、F用所对应的元素符号表示)
A | A原子核外电子有6种不同的运动状态 |
B | B元素的第一电离能比同周期相邻两个元素都大 |
C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
D | D原子最外层电子数等于电子层数 |
E | E的基态原子最外层电子排布式为3s23p2 |
F | F与C位于不同周期,F原子核外最外层电子数与C相同,其余各层电子均充满 |
(1)F基态原子核外价电子排布式是________________
(2)A、B、E三种元素电负性由大到小排列顺序为__________________
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如右图所示,其原子的杂化类型为________________

(4)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
2BO2(g) ![]() B2O4(g) △H2=-56.9 kJ/mol
B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式__________________
(5)D单质为面心立方晶体,其晶胞边长a=0.405nm,用NA表示阿伏伽德罗常数,列式表示D单质的密度______g·cm-3(不必计算出结果)。
(6)继A60后,科学家又合成了E60、B60, E60分子中每个E原子只跟相邻的3个原子形成共价键,且每个E原子最外层都满足8电子稳定结构,则E60分子中π键的数目为_______________
(7)F的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出该原电池正极反应方程式_______________
(8)某学生所做的有关F元素的实验流程如下图:
F单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。下列说法不正确的是 ( )
A. 金属钠可以保存在石蜡油中,并贴上如图标志
B. 夏天雷雨过后空气特别清新是因为空气中产生了少量臭氧
C. 石油的裂解可以得到甲烷、乙烯、丙烯等重要化工原料
D. 煤中含有苯、甲苯和粗氨水,可通过干馏得到上述产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种相邻短周期主族元素的相对位置如表,元素X的原子核外电子数是元素M的2倍,Y的氧化物具有两性。下列说法不正确的是
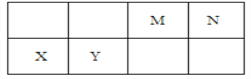
A. 基态Y原子中存在6种能量不同的电子
B. X位于第三周期IIA ,其单质可采用电解熔融其氯化物制备
C. 元素最高价氧化物的水化物中,酸性最强的是HNO3
D. 气体分子(MN)2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
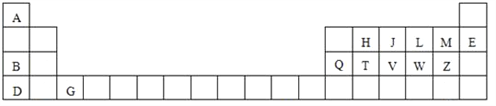
(1)原子半径最大的元素是_______;在化合物中只有负价的元素是 _______;属于副族元素是_______;适合作半导体材料的是_______,(只用表中的字母填写)
(2)V在周期表中的位置第_______周期第_______族。.
(3)M原子基态电子排布式为___________________________________。
L原子基态电子排布图为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质(X)是有机合成中重要中间体,下列关于它的说法正确的是( )
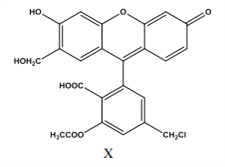
A. 1 mol X 与与足量的 NaOH 溶液反应, 最多消耗 6mol NaOH
B. 1 mol X 最多能与 10mol 氢气反应,且生成物中无手性碳原子
C. 1mol X 与足量的浓溴水反应,最多消耗 2mol Br2
D. X 分子式为 C24H17O8Cl,是芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33℃,沸点:73℃。实验室可用下图所示装置制取ICl3 :

(1)仪器a 的名称是 。
(2)制备氯气选用的药品为漂白粉固体[主要成分为Ca(ClO)2]和浓盐酸,有关反应的化学方程式为 。
(3)装置B(吸滤瓶)即可用于除杂,也是安全瓶,能监侧实验进行时装置C中是否发生了堵塞。请描述发生堵塞时B中现象 。
(4)试剂X为 。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医疗上绿矾(FeSO47H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:

Ⅰ.【制备产品】该小组由废铁屑(含少量油污、氧化铜、氧化铁等杂质),用如图所示装置制备FeSO47H2O晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是_________________,然后将废铁屑用水洗涤2~3遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中。加稀硫酸进行反应前要持续通入N2,通入N2的作用是____________________。
(3)加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为_________。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤。将滤液____________,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存产品。
Ⅱ.【测定FeSO47H2O含量】
(1)称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、玻璃棒、烧杯、量筒外,还需要的仪器有(填仪器名称)___________、_____________。
(2)用移液管准确移取25.00mL该液体于锥形瓶中,用0.1000mol/LKMnO4标准溶液滴定,则滴定终点的判断方法是__________________________________。
(3)用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO47H2O的质量分数为_________。(已知Mr(FeSO47H2O)=278)。
(4)若测量结果偏小,可能是在用标准溶液滴定时由下列___(填序号)操作导致。
A.锥形瓶蒸馏水洗后未干燥,也未用待测液润洗
B.酸式滴定管未用标准液润洗就直接用于盛装待测液
C.滴定终点时,俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com