
分析 ①2NO(g)+O2(g)═2NO2(g)△H1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2
③2NO2(g)?N2O4(g)△H3
④2N2O5(g)═4NO2(g)+O2(g)△H4
将方程式②-$\frac{1}{2}$①-③-$\frac{1}{2}$④得N2O4(g)+O3(g)═N2O5(g)+O2(g),焓变进行相应的改变.
解答 解:①2NO(g)+O2(g)═2NO2(g)△H1
②NO(g)+O3(g)═NO2(g)+O2(g)△H2
③2NO2(g)?N2O4(g)△H3
④2N2O5(g)═4NO2(g)+O2(g)△H4
将方程式②-$\frac{1}{2}$①-③-$\frac{1}{2}$④得N2O4(g)+O3(g)═N2O5(g)+O2(g),
则该反应△H=△H2-$\frac{1}{2}$△H1-△H3-$\frac{1}{2}$△H4,
故答案为:△H2-$\frac{1}{2}$△H1-△H3-$\frac{1}{2}$△H4.
点评 本题考查盖斯定律,为高频考点,由已知方程式正确构建目标方程式是解本题关键,侧重考查学生分析计算能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 等PH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| B. | 等体积、等物质的量浓度的NaCl和NaClO溶液中离子总数(N):N(NaCl)<N(NaClO) | |
| C. | 将10mol0.1mol•L-1Na2CO3溶液逐渐滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| D. | 室温下,向0.1mol•L-1的醋酸钠溶液中通入氯化氢气体,使溶液的pH=7:>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若HA 的电离能力大于A-的水解能力,则有c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) | |
| B. | 若A-的水解能力大于HA 的电离能力,则有c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+) | |
| C. | 无论该溶液呈酸性还是碱性,都有 c(Na+)+c(H+)=c(A-)+c(OH-) | |
| D. | 无论该溶液呈酸性还是碱性,都有2c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
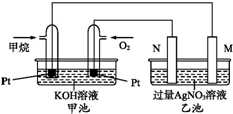 如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.
如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 外观 | 在空气中加热时的现象 | 产物水溶液的酸碱性 |
| X | 黑色粉未 | 燃烧时呈炽红色并发出火花,放出无色气体G | 微弱酸性 |
| Y | 淡黄色晶体 | 首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 | 弱酸性 |
| Z | 银白色固体 | 燃烧,产生黄色火焰,生成浅黄色固体F | 强碱性 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1NA个水分子所占的体积约是2.24 L | |
| B. | 常温常压下,11.2 L CO2中含有11NA个电子 | |
| C. | CH4的摩尔质量和NA个甲烷分子的质量相等 | |
| D. | 常温下,64gSO2气体中含有的原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com