
【题目】钠碱循环法可脱除烟气中的SO2.在钠碱循环中,吸收液为Na2SO3溶液,当吸收液的pH降为6左右时,可采用三室膜电解技术使其再生,图为再生示意图。下列说法正确的是( )
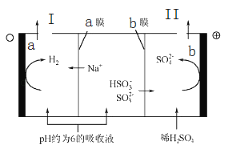
A.a极为电池的阳极
B.a极区吸收液再生的原理是HSO3﹣+H+═H2O+SO2↑
C.b电极的电极反应式是HSO3﹣﹣2e﹣+H2O═SO42﹣+3H+
D.b膜为阳离子交换膜
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】将7g铁粉投入400mL1mol/LHNO3溶液中,还原产物为NO。若反应后溶液的体积不变,下列说法错误的是( )
A.生成气体在标准状况下为2.24L
B.反应后溶液中c(Fe3+)=0.125mol/L
C.反应后的溶液再投入2.8g铁粉可全部溶解
D.反应后溶液中c(NO3-)=0.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
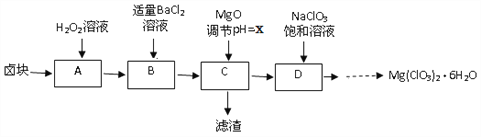
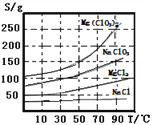
已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数,下列说法正确的是( )
A.16gO2与O3的混合气体中含有的原子数为NA
B.100g46%的乙醇(C2H5OH)溶液共含氢原子数6NA
C.7.8gNa2O2含有的离子数为0.4NA
D.0.1molFe在足量氧气中燃烧,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+3B(g)![]() 2C(g)△H<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是( )
2C(g)△H<0,有甲乙两个容积为0.5L的密闭容器,向甲中加入1molA和3molB,5min时达到平衡,放出热量为Q1kJ;相同条件下,向乙中加入2molC,达到平衡时吸收热量为Q2kJ。已知Q2=3Q1,下列说法正确的是( )
A.甲中达平衡时,用B的浓度变化表示5min内的平均反应速率为0.15 molL-1min-1
B.乙中的热化学方程式为2C(g)![]() A(g)+3B(g):△H=+4/3Q2 kJ/mol
A(g)+3B(g):△H=+4/3Q2 kJ/mol
C.乙中达到平衡后,再加入0.25molA、0.75molB、1.5molC,与原平衡互为等效平衡,平衡不移动
D.乙中平衡时C的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+转化为Fe3+,下列物质可作氧化剂的是__(填字母)。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液pH至4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用___(填字母)。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH至4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就被认定为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5mol·L-1]时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像相符的是( )
A.向含有盐酸、氯化镁和氯化铝的溶液中逐滴加入NaOH溶液直至过量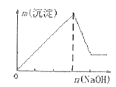
B.向澄清石灰水中通入CO2气体直至过量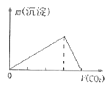
C.向NaAlO2溶液中逐滴加入盐酸直至过量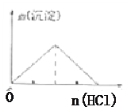
D.向AlCl3溶液中逐滴加入氨水直至过量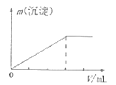
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氨溴索(又称溴环己胺醇),可用于急、慢性支气管炎及支气管扩张、肺气肿、肺结核等疾病的治疗。某研究小组拟用以下流程合成盐酸氨溴索和糖精的中间体X(部分反应条件及产物已略)。
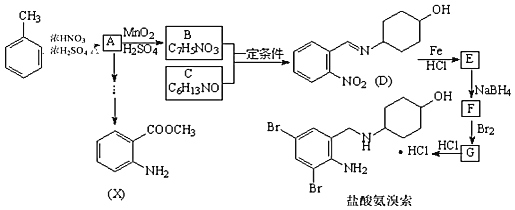
已知信息:
(Ⅰ)R1CHO+R2NH2![]() R1CH=N﹣R2
R1CH=N﹣R2
(Ⅱ)![]()
![]()
![]() (易被氧化)
(易被氧化)
请回答:
(1)流程中A名称为_____;D中含氧官能团的名称是_____。
(2)G的分子式为_____;化合物E的结构简式是_____。
(3)A→B、F→G的反应类型分别为:_____、_____。
(4)写出B+C![]() D 的化学方程式_____。
D 的化学方程式_____。
(5)化合物X同时符合下列条件的同分异构体H有_____种;其中核磁共振氢谱有5组吸收峰的结构简式为_____。
①苯环上有两个取代基,其中之一是氨基;②官能团与X相同,苯环上的一氯代物有两种。
(6)以甲苯和甲醇为有机原料,参照盐酸氨溴索的合成路线图,设计X的合成路线______(无机试剂任选,标明试剂、条件及对应物质结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国和瑞典的科学家共同发现了治疗非典的新方法:吸入一氧化氮可快速改善重症非典患者的缺氧状况,缓解病情。病毒学研究同时证实,一氧化氮对非典病毒有直接抑制作用。下列有关NO的说法不正确的是()
A.NO可看作亚硝酸![]() 的酸酐
的酸酐
B.NO任意排放会造成大气污染
C.实验室制取NO气体可用排水法收集
D.氨催化氧化可生成NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com