
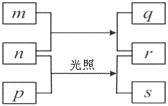
【题目】短周期元素W、X、Y、Z的原子序数依次增加。
① m、p、r是由这些元素组成的二元化合物;
② n是元素Z的单质,通常为黄绿色气体;
③ q具有强氧化性,q的水溶液常用于漂白和杀菌;
④ 0.01 mol·L1r溶液的pH为2,p是最简单的有机物,s通常是难溶于水的混合物。
上述物质的转化关系如图所示,回答下列问题。
(1)Y原子的结构示意简图是 。
(2)X、Y、Z的原子半径由大到小的顺序是 (用元素符号表示)。
(3)r的电子式为 ;物质n的用途有 (任写一种即可)。
(4)q与等物质的量的NaOH反应后得到的溶液呈碱性的原因是 (用离子方程式表示)。
(5)W、X、Y按原子个数比为2 :1 :1组成化合物t能与NaHCO3溶液反应产生气泡(质谱分析法测得t的相对分子质量为60),化合物t是 (写名称)。
(6)常温常压下2.4g的p完全燃烧放出133.6kJ的热量,该反应的热化学方程式是 。
【答案】(1)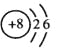 (2分)
(2分)
(2)r(Cl)>r(C)>r(O)(或Cl>C>O)(2分)
(3)![]() (2分);生产盐酸(生产漂白粉等合理答案均给分)(1分)
(2分);生产盐酸(生产漂白粉等合理答案均给分)(1分)
(4)ClO-+H2O![]() HClO+OH-(2分)(5)乙酸(或醋酸)(2分)
HClO+OH-(2分)(5)乙酸(或醋酸)(2分)
(6)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.7kJ·mol-1(3分)
【解析】试题分析:短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物;n是元素Z的单质,通常为黄绿色气体,则n是氯气,Z是Cl;q具有强氧化性,q的水溶液常用于漂白和杀菌,因此q是次氯酸,则m是水,r是氯化氢,W是H;0.01 mol·L1r溶液的pH为2,p是最简单的有机物,p是甲烷,所以X是C,Y是O。s通常是难溶于水的混合物,属于甲烷的卤代烃。
(1)氧原子的结构示意简图是 。
。
(2)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则X、Y、Z的原子半径由大到小的顺序是)r(Cl)> r(C)> r(O)。
(3)氯化氢是共价化合物,电子式为![]() ;氯气的用途有生产盐酸(生产漂白粉等)。
;氯气的用途有生产盐酸(生产漂白粉等)。
(4)次氯酸根离子水解,溶液显碱性,离子方程式为ClO-+ H2O![]() HClO+ OH-。
HClO+ OH-。
(5) W、X、Y按原子个数比为2 :1 :1组成化合物t能与NaHCO3溶液反应产生气泡(质谱分析法测得t的相对分子质量为60),化合物t是乙酸(或醋酸)。
(6)常温常压下2.4g甲烷是0.15mol,p完全燃烧放出133.6kJ的热量,所以1mol甲烷完全燃烧放出的热量是![]() ,因此该反应的热化学方程式是CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) △H = -890.7kJ·mol-1。
,因此该反应的热化学方程式是CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) △H = -890.7kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
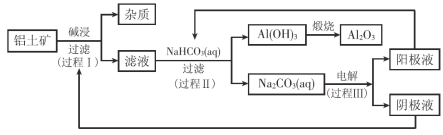
(1)过程I,发生反应的离子方程式是 。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
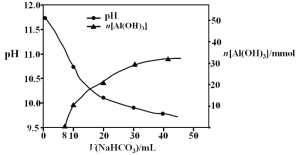
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是 。
② 过程II生成Al(OH)3的离子方程式是 。
(3)过程III,电解Na2CO3溶液的装置如下图所示。
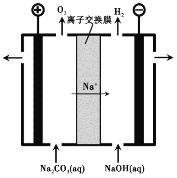
① 阴极的电极反应式是 。
② 简述阳极液生成的原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 molL-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
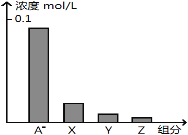
A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.纯碱溶液呈碱性,但纯碱不是碱
B.在盛有热的氨水的烧杯中滴加饱和FeCl3溶液制备氢氧化铁胶体
C.在水溶液中电离产生H+的化合物一定是酸
D.盐、 碱一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是
A. H2SO4、HNO3、CH3COOH 均属于酸
B. NO、CO、NO2均属于酸性氧化物
C. NaCl、CuSO4、NH3·H2O均属于盐
D. H2S、HCl、NH3均属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,下列用品的有效成分及用途对应错误的是( )
A. 食盐既可以做调味剂,又可以做防腐剂
B. 纯碱既可以做清洗品,又可以做发酵粉
C. 漂白粉既可以做消毒剂,又可以做漂白剂
D. 酒精既可以做饮料,又可以做燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是另一种元素周期表——三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是
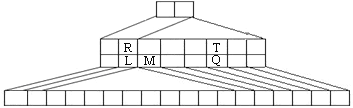
A.Q、T两元素的氢化物的稳定性为HnT<HnQ
B.L、R的单质与盐酸反应速率为R>L
C.M与T形成的化合物有两性
D.L、Q形成的简单离子核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com