
为了比较①H﹣OH,②CH3COOH,③CH3CH2﹣OH,④H2CO3,⑤苯酚五种物质分子中﹣OH上氢原子的活动性顺序,某课外活动小组设计了如下表所示的实验方案.请你利用有关实验仪器及给出的试剂,填写表中的空格,完成上述实验方案.可供选用的试剂有:紫色石蕊试液、金属钠、氢氧化钠溶液、碳酸钠溶液.实验中所需仪器自选.
| 实验步骤和操作 | 实验现象 | 结论(﹣OH上氢原子活动性顺序) |
| (1)五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 | ②④变红,其它不变 | ②、④>①、③、⑤ |
| (2) | ||
| (3)①、③、⑤各取少量于试管中,各加入少量NaOH溶液 | ⑤由浑浊变澄清 | ⑤>①、③ |
| (4) |
(5)通过以上实验比较,从而得出这五种物质分子中﹣OH上氢原子的活动性由强到弱的顺序为 (填序号)
考点:
性质实验方案的设计;乙醇的化学性质;苯酚的化学性质;乙酸的化学性质.
专题:
实验题.
分析:
根据编号1实验可知 ②乙酸和④碳酸 显酸性能使石蕊变红,所以②乙酸④碳酸 氢原子活泼性强于①H﹣OH②乙醇 ③苯酚;
根据编号3实验可知苯酚具有弱酸性,可以和氢氧化钠反应,所以⑤苯酚羟基氢原子活泼性强于①H﹣OH③CH3CH2﹣OH;
由实验2应是确定乙酸和碳酸酸性强弱,可通过是否与碳酸钠反应来区别;
根据编号4应是确定水和乙醇中氢原子活动性强弱,可通过与钠反应来区别.
解答:
解:本实验目的是比较不同物质的羟基中氢原子的活泼性.
通过实验1分别取5种溶液,滴加紫色石蕊溶液溶液变红的是②④溶液,可知②乙酸④碳酸 氢原子活泼性强于①H﹣OH②乙醇 ③苯酚;
通过实验3:①、③、⑤各取少量于试管中,各加入少量NaOH溶液,⑤由浑浊变澄清,说明苯酚显酸性酸性能与氢氧化钠溶液发生酸碱中和反应方程式为:C6H5OH+NaOH→C6H5ONa+H2O,故⑤苯酚羟基氢原子活泼性强于①H﹣OH③CH3CH2﹣OH;
通过实验2可确定②乙酸中羟基氢原子活泼性强于④碳酸,故操作为:②、④各取少量于试管中,各加少量碳酸钠溶液,现象为②中产生气体,④中无现象,可证明氢活动性②>④;
根据编号4应是确定水和乙醇中氢原子活动性强弱,可通过与钠反应来区别,故操作为:①、③各取少量于试管中,各加入少量钠,现象为:①中产生气体剧烈,③在产生气体平缓,得出结论氢活动性①>③.
故答案为:
| 实验步骤和操作 | 实验现象 | 结论(﹣OH上氢原子活动性顺序) |
| (1)五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 | ②④变红,其它不变 | ②、④>①、③、⑤ |
| (2)②、④各取少量于试管中,各加少量碳酸钠溶液 | ②中产生气体,④中无现象 | ②>④ |
| (3)①、③、⑤各取少量于试管中,各加入少量NaOH溶液 | ⑤由浑浊变澄清 | ⑤>①、③ |
| (4)①、③各取少量于试管中,各加入少量钠 | ①中产生气体剧烈,③在产生气体平缓 | ①>③ |
(2)所以5种物质的羟基中的氢原子的活泼性由强到弱的顺序是乙酸、碳酸、苯酚、水、乙醇;
故答案为:②>④>⑤>①>③.
点评:
本题考查了不同环境下羟基氢原子的活泼性,注意实验的设计和结论的得出.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、CO32﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()
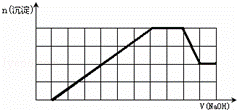
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42﹣和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 乙酸与碳酸钠溶液反应:2H++CO32﹣═CO2↑+H2O |
|
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO﹣+2H2O |
|
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O﹣+CO2+H2O |
|
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 , K
): 5.0×10-16 , K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀 。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。


(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组决定用实验探究的方法证明化学反应具有一定的限度,在一定条件下会达到“平衡状态”。取5 mL 0.1 mol·L-1 KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-===2Fe2++I2。为证明该反应具有可逆性且达到一定限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。
结合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验①不合理,你认为是____________;
改进的方法是________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol·L﹣1、0.001mol·L﹣1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol·L﹣1)的用量均为2mL.
(1)配平化学方程式:
KMnO4+ H2C2O4+ H2SO4→ K2SO4+ MnSO4+ CO2+ H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol·L﹣1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和 ④ 探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是
若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol·L﹣1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
计算用0.001 mol·L﹣1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率 (忽略混合前后溶液体积的变化).
(5)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? .若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com