
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:______________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
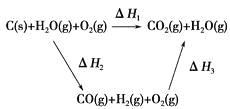
请甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
【答案】C(s)+H2O(g)=CO(g)+H2(g) ΔH=131.5 kJ·mol-1 乙 甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2+ΔH3且ΔH2>0) ①减少污染;②燃烧充分;③方便输送
【解析】
(1)根据盖斯定律写出热化学方程式;
(2)根据盖斯定律可知两种途径放出的热量相同;
(3)将煤转化为水煤气有减少污染、燃烧充分、方便运输等优点。
(1)本题考查盖斯定律,ΔH1-ΔH2-ΔH3即为C(s)与水蒸气反应的焓变。因此C(s)与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=131.5 kJ·mol-1。
(2)根据盖斯定律,煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量应相等,甲同学的错误在于忽视了煤转化为水煤气时要吸收热量。


科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关,下列说法中不正确的是
A.2020年北京冬奥会速滑服主要材料是聚氨酯,属于有机高分子化合物
B.用CO2生产可降解塑料![]() ,原子利用率100%,符合绿色化学原则
,原子利用率100%,符合绿色化学原则
C.生活中菜叶、鱼骨等垃圾可以作为沼气原料,沼气属于不可再生能源
D.我国成功研制世界最大口径单体碳化硅反射镜,碳化硅属于无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。
(1)已知; ![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=-119.6kJ/mol
(g) H=-119.6kJ/mol
![]() (g)+2H2(g)→
(g)+2H2(g)→![]() (g) H=-237.1kJ/mol
(g) H=-237.1kJ/mol
![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g) H=-208.4kJ/mol
(g) H=-208.4kJ/mol
请求出![]() (g)+H2(g)→
(g)+H2(g)→![]() (g) H=________kJ/mol
(g) H=________kJ/mol
(2)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
![]() (g)
(g)![]()
![]() (g)+3H2(g)
(g)+3H2(g)
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_______(用含a、b的关系式表达)。
(3)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
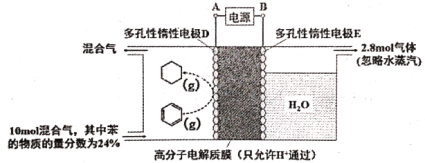
①实现有机物储氢的电极是__________;A 正极 B 负极 C 阴极 D 阳极
其电极反应方程为:___________。
②实验研究表明,当外加电压超过一定值以后,发现电极D产物中苯(g)的体积分数随着电压的增大而减小,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是__________。已知单质气体为2 mol,求此装置的电流效率η=__________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。已知:25℃ 时,Kb(NH3·H2O)=1.8×10-5; H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7。
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到平衡状态的依据是 ________(填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸气和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80% 时放出热量19.6kJ能量,写出该反应的热化学方程式__________________。
②一定条件下,往 2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内 CO2的转化率随温度的变化如图1所示:
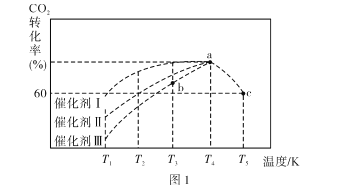
催化剂效果最佳的是催化剂________(填“Ⅰ”“Ⅱ”“Ⅲ”)。b点v( 正 )________v( 逆 )( 填“>”“<”或“=”) 。此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因_____。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=____________KPa-2 。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
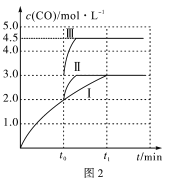
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH<0,一定温度下,在3L容积可变的密闭容器中发生如上反应,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔的叙述错误的是( )
A.聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B.聚乙炔的化学式为![]() 分子中所有碳原子不可能在同一直线上
分子中所有碳原子不可能在同一直线上
C.聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D.聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
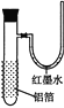
A.铝与硝酸汞反应属放热反应
B.铝是一种较活泼的金属,
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)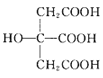 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
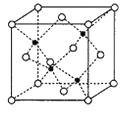
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com