
 ŌŚ537”ę”¢1.01”Į105PaŹ±£¬ĶłČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ³äČė1mol XŗĶ3mol Y£¬“ĖŹ±ČŻ»żĪŖV L£®±£³ÖŗćĪĀŗćŃ¹£¬·¢Éś·“Ó¦X£Øg£©+3Y£Øg£©?2Z£Øg£©£¬“ļµ½Ę½ŗāŹ±£¬Ę½ŗā»ģŗĻĘųĢåÖŠZµÄĢå»ż·ÖŹżĪŖ0.5£®
ŌŚ537”ę”¢1.01”Į105PaŹ±£¬ĶłČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ³äČė1mol XŗĶ3mol Y£¬“ĖŹ±ČŻ»żĪŖV L£®±£³ÖŗćĪĀŗćŃ¹£¬·¢Éś·“Ó¦X£Øg£©+3Y£Øg£©?2Z£Øg£©£¬“ļµ½Ę½ŗāŹ±£¬Ę½ŗā»ģŗĻĘųĢåÖŠZµÄĢå»ż·ÖŹżĪŖ0.5£®·ÖĪö ŗćŃ¹ĻĀ X£Øg£©+3Y£Øg£©$\stackrel{\;}{?}$2Z£Øg£©£¬
æŖŹ¼ 1 3 0
×Ŗ»Æ x 3x 2x
Ę½ŗā1-x 3-3x 2x
µ½Ę½ŗāŹ±£¬Ę½ŗā»ģŗĻĘųĢåÖŠZµÄĢå»ż·ÖŹżĪŖ0.5£¬
Ōņ$\frac{2x}{4-2x}$=0.5£¬½āµĆx=$\frac{2}{3}$mol£¬ŅŌ“Ė½įŗĻµČŠ§Ę½ŗāĄ“½ā“šøĆĢā£®
½ā“š ½ā£ŗŗćŃ¹ĻĀ X£Øg£©+3Y£Øg£©$\stackrel{\;}{?}$2Z£Øg£©£¬
æŖŹ¼ 1 3 0
×Ŗ»Æ x 3x 2x
Ę½ŗā 1-x 3-3x 2x
µ½Ę½ŗāŹ±£¬Ę½ŗā»ģŗĻĘųĢåÖŠZµÄĢå»ż·ÖŹżĪŖ0.5£¬
Ōņ$\frac{2x}{4-2x}$=0.5£¬½āµĆx=$\frac{2}{3}$mol£¬
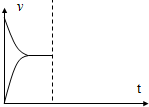
£Ø1£©XµÄ×Ŗ»ÆĀŹŌ¼ĪŖ$\frac{\frac{2}{3}mol}{1mol}$”Į100%=66.7%£¬ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬ŌŁĶØČė1mol XŗĶ3mol YµÄ»ģŗĻĘųĢ壬ÓÉÓŚŃ¹Ēæ²»±ä£¬ŌņĖŁĀŹ²»±ä£¬Ķ¼ĻóĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ66.7%£» £¬£»
£¬£»
£Ø2£©±£³ÖÉĻŹöĪĀ¶ČŗĶŃ¹Ēæŗć¶Ø²»±ä£¬ČōĻņČŻĘ÷ÖŠÖ»³äČė4molZ£¬ÓėÉĻŹöĘ½ŗāµČŠ§£¬ŌņYµÄĢå»ż·ÖŹżĪŖ$\frac{3-3”Į\frac{2}{3}}{4-2”Į\frac{2}{3}}$”Į100%=37.5%£¬
ÓÉĪļÖŹµÄĮæÓėĢå»ż³ÉÕż±ČæÉÖŖ£¬ÉčĘ½ŗāµÄĢå»żĪŖx£¬Ōņ$\frac{4}{V}=\frac{\frac{8}{3}”Į2}{x}$£¬½āµĆx=$\frac{4V}{3}$L£¬¹Ź“š°øĪŖ£ŗ37.5%£»$\frac{4V}{3}$£»
£Ø3£©ČŻ»ż¹Ģ¶Ø²»±äµÄĆܱÕČŻĘ÷£¬ČŌæŲÖĘĪĀ¶Č²»±ä£¬Ź¹2mol XŗĶ6mol Y·“Ó¦£¬“ļµ½Ę½ŗāŹ±Ę½ŗāĘųĢåÖŠZµÄĢå»ż·ÖŹżČŌĪŖ0.5£¬
Óė¼ÓČė4molZ½ØĮ¢µÄĘ½ŗāµČŠ§£¬Ģå»żĪŖ$\frac{4V}{3}$L£¬¹Ź“š°øĪŖ£ŗ$\frac{4V}{3}$£»
£Ø4£©ČŻĘ÷Ģå»ż±£³ÖVL²»±ä£ØŗćČŻ£©£¬ĶłĘäÖŠ³äČėa mol XµÄb mol Y£¬Ź¹·“Ó¦“ļµ½Ę½ŗā£¬ÕāŹ±Ę½ŗāĘųĢåÖŠZµÄĢå»ż·ÖŹżČŌĪŖ0.5£¬ĢåĻµŃ¹ĒæĪŖ1.01”Į105Pa£¬Čōa£ŗb=1£ŗ3£¬Ōņ X£Øg£©+3Y£Øg£©$\stackrel{\;}{?}$2Z£Øg£©£¬
æŖŹ¼ a 3a 0
×Ŗ»Æ x 3x 2x
Ę½ŗāa-x 3a-3x 2x
µ½Ę½ŗāŹ±£¬Ę½ŗā»ģŗĻĘųĢåÖŠZµÄĢå»ż·ÖŹżĪŖ0.5£¬
$\frac{2x}{4a-2x}$=0.5£¬4a-2x=4mol£¬
½āµĆa=1.5mol£¬¹Ź“š°øĪŖ£ŗ1.5mol£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć¼°µČŠ§Ę½ŗā£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪö”¢¼ĘĖćÄÜĮ¦µÄ漲飬עŅā»ÆŃ§Ę½ŗāČż¶Ī·ØµÄ¼ĘĖć¼°µČŠ§Ę½ŗāµÄĢõ¼ž”¢Ģå»żÓėĪļÖŹµÄĮæµÄ¹ŲĻµ¼“æɽā“š£¬ĢāÄæÄŃ¶Č½Ļ“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
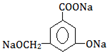
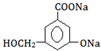
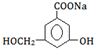
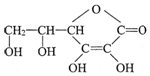 £¬·Ö×ÓŹ½ĪŖC6H8O6£»ĘäÖŠµÄ-OH½ŠōĒ»ł£ØĢī¹ŁÄÜĶÅĆū³Ę£©£®ŌŚĪ¬ÉśĖŲCČÜŅŗÖŠµĪČėÉŁĮæĄ¶É«µÄŗ¬ÓŠµķ·ŪµÄµāĖ®£¬æɹŪ²ģµ½µÄĻÖĻóŹĒĄ¶É«ĶŹČ„£¬ĖµĆ÷Ī¬ÉśĖŲCÓŠ»¹ŌŠŌ£ØĢīŃõ»ÆŠŌ»ņ»¹ŌŠŌ£©£®
£¬·Ö×ÓŹ½ĪŖC6H8O6£»ĘäÖŠµÄ-OH½ŠōĒ»ł£ØĢī¹ŁÄÜĶÅĆū³Ę£©£®ŌŚĪ¬ÉśĖŲCČÜŅŗÖŠµĪČėÉŁĮæĄ¶É«µÄŗ¬ÓŠµķ·ŪµÄµāĖ®£¬æɹŪ²ģµ½µÄĻÖĻóŹĒĄ¶É«ĶŹČ„£¬ĖµĆ÷Ī¬ÉśĖŲCÓŠ»¹ŌŠŌ£ØĢīŃõ»ÆŠŌ»ņ»¹ŌŠŌ£©£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £®
£® £®
£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
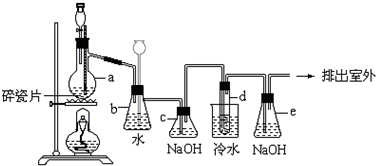
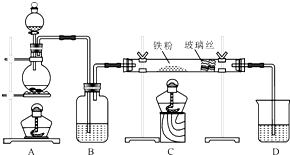 ¹¤ŅµÉĻ£¬Ļņ500”ꔫ600”ęµÄĢśŠ¼ÖŠĶØČėĀČĘųÉś²śĪŽĖ®ĀČ»ÆĢś£ØŅŃÖŖ³ćČČĢśŠ¼ÓėĀČ»ÆĒāÉś³ÉĀČ»ÆŃĒĢś£©£®ĻÖÓĆČēĶ¼ĖłŹ¾µÄ×°ÖĆÄ£ÄāÉĻŹö¹ż³Ģ½ųŠŠŹŌŃ飮
¹¤ŅµÉĻ£¬Ļņ500”ꔫ600”ęµÄĢśŠ¼ÖŠĶØČėĀČĘųÉś²śĪŽĖ®ĀČ»ÆĢś£ØŅŃÖŖ³ćČČĢśŠ¼ÓėĀČ»ÆĒāÉś³ÉĀČ»ÆŃĒĢś£©£®ĻÖÓĆČēĶ¼ĖłŹ¾µÄ×°ÖĆÄ£ÄāÉĻŹö¹ż³Ģ½ųŠŠŹŌŃ飮²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
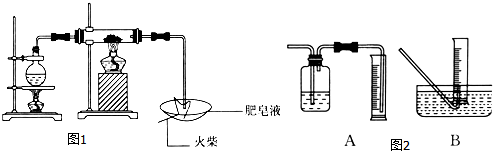
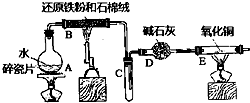 ijŠ£»ÆѧŠ”×éѧɜĄūÓĆČēĶ¼ĖłĮŠ×°ÖĆ½ųŠŠ”°ĢśÓėĖ®·“Ó¦”±µÄŹµŃ飬²¢½ųŠŠĮĖĘäĖūÓŠ¹ŲŹµŃ飮£ØĶ¼ÖŠ¼Š³Ö¼°Ī²Ęų“¦Ąķ×°ÖĆ¾łŅŃĀŌČ„£©
ijŠ£»ÆѧŠ”×éѧɜĄūÓĆČēĶ¼ĖłĮŠ×°ÖĆ½ųŠŠ”°ĢśÓėĖ®·“Ó¦”±µÄŹµŃ飬²¢½ųŠŠĮĖĘäĖūÓŠ¹ŲŹµŃ飮£ØĶ¼ÖŠ¼Š³Ö¼°Ī²Ęų“¦Ąķ×°ÖĆ¾łŅŃĀŌČ„£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź¹ÓĆ“ß»Æ¼ĮÄܼÓæģ·“Ó¦ĖŁĀŹ | |
| B£® | Ń¹ĒæŌö“ó²»Ó°Ļģ»Æѧ·“Ó¦ĖŁĀŹ | |
| C£® | ¶¬ĢģĘųĪĀµĶ£¬·“Ó¦ĖŁĀŹ½µµĶ£¬¶ŌČĖĄąĪ£ŗ¦¼õŠ” | |
| D£® | ĪŽĀŪĶā½ēĢõ¼žŌõŃłøı䣬¾ł¶Ō“Ė»Æѧ·“Ó¦µÄĖŁĀŹĪŽÓ°Ļģ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com