
A.2e-,H2SO4 B.4e-,SO
科目:高中化学 来源: 题型:
下列实验操作完全正确的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.

查看答案和解析>>
科目:高中化学 来源: 题型:
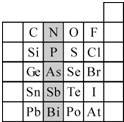
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三第二次综合考试化学试卷(解析版) 题型:选择题
下列实验操作完全正确的是( )
|
编号 |
实验 |
操作 |
|
A |
证明SO2有漂白性 |
将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 |
|
B |
配制1000mL一定物质的量浓度的硫酸溶液 |
准确称取一定体积浓硫酸,放入到1000mL的容量瓶中,加水稀释,振荡摇匀定容 |
|
C |
除去FeC13溶液中混有的FeC12 |
向溶液中通入过量氯水,然后加热煮沸就得到了纯净的FeC13溶液 |
|
D |
检验Brˉ的存在 |
在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省日照市高三12月月考化学试卷 题型:选择题
下列实验操作完全正确的是
|
编号 |
实验 |
操作 |
|
A |
证明SO2有漂白性 |
将SO2气体通入紫色石蕊试液中,观察溶液是否退色 |
|
B |
配制一定物质的量浓度的硫酸溶液1000mL |
准确量取一定体积浓硫酸,放入到1000mL的容量瓶中,加水稀释,振荡摇匀定容 |
|
C |
除去FeCl3溶液中混有的FeCl2 |
向溶液中通入过量氯水,然后加热煮沸就得到了纯净的FeCl3溶液 |
|
D |
检验Br—的存在 |
在溶液中先加入氯水再加入CCl4,振荡、静置,观察下层溶液显橙红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com