
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
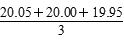 mL=20.00 mL,则c(CH3COOH)=0.200 0 mol/L。
mL=20.00 mL,则c(CH3COOH)=0.200 0 mol/L。

科目:高中化学 来源:不详 题型:单选题
| A.反应后的溶液呈酸性 |
| B.两种反应物中水电离出的c(H+)都是1×10-12 mol·L-1 |
| C.反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol·L-1 |
| D.反应后的溶液中:c(Na+) >c(CH3COO-)>c( OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾溶液加热 | B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl | D.小苏打溶液中加入少量的NaCl固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.x为弱酸,Vx<Vy | B.x为强酸,Vx>Vy |
| C.y为弱酸,Vx<Vy | D.y为强酸,Vx>Vy |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.醋酸的电离程度逐渐增大,溶液的PH值减小 |
| B.水的电离程度增大 |
| C.Kw逐渐减小 |
D.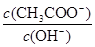 变大 变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
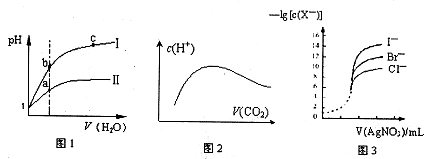
| A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为 c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3 H++HCO3— H++HCO3—HCO3—  H++CO32— H++CO32— | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4 H++H2PO4— H++H2PO4—H2PO4—  H++HPO42— H++HPO42—HPO42—  H++PO43— H++PO43— | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存 |
| D.已知:Ksp(AgCl)=1.8×10-10, Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com