
| A、采用焚烧或深埋的方法处理垃圾 |
| B、推广使用太阳能、风能等新能源 |
| C、提高煤和石油的产量以满足社会对能源的需求 |
| D、将未经处理的工业废水直接排入江河湖泊 |


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
| A、0.5mol/L的MgCl2溶液,含有Cl-个数为 NA |
| B、2.3 g Na+离子中含有的电子数为1 NA |
| C、标准状况下,1摩尔SO3的体积为22.4 L |
| D、标准状况下,11.2 L H2O所含的分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述离子中至少存在6种 |
| B、一定存在Cl-,且c(Cl-)=0.4 mol?L-1 |
| C、一定存在SO42-、NH4+,可能不存在K+ |
| D、一定不存在CO32-、Al3+、K+,一定存在NO3-,且c(NO3- )=0.2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B中一定含有羧基和羟基 |
| B、B中一定含有羧基 |
| C、B中可能含有醛基 |
| D、B中一定不含羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
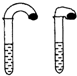 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3粉末同时倒入试管中,观察到现象如下:| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 2.5g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 2.5g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N和P是植物营养素,海洋或湖泊中N、P含量越高越有利于水生动植物的生长 |
| B、只要不喝被重金属污染的水就不会中毒,因此水中的重金属污染对人类影响不大 |
| C、用熟石灰处理钢铁厂的酸性废水,利用的是复分解反应原理 |
| D、用Na2S处理含Hg2+废水使Hg2+变成HgS沉淀而除去,利用的是氧化还原反应原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com