
| A. | 原溶液可能存在K+、SO42- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液肯定只存在NH4+、SO32- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
分析 某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液加入少量溴水,溶液呈无色,说明溶液中无Fe3+,且有还原性离子将Br2还原,且所得产物无色,由于还原性SO32->I-,故溶液中可能不含I-,也可能I-未反应,但溶液中一定含SO32-,由于有SO32-则无Ba2+;继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,此沉淀为BaSO4,沉淀经洗涤、高温干燥后质量为4.66g,即BaSO4的物质的量为0.02mol,但由于溶液中一定含SO32-,故生成的0.02molBaSO4中的SO42-可能全部来自于被氧化的SO32-,也可能溶液中原来含有SO42-;滤液加足量NaOH溶液、加热,生成气体为NH3,即原来溶液中一定含NH4+,在标准状况下体积为1120mL,故NH4+的物质的量为0.05mol,根据溶液的电中性来判断K+的存在,以此解答该题.
解答 解:某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种.
现取100mL溶液加入少量溴水,溶液呈无色,说明溶液中无Fe3+,且有还原性离子将Br2还原,且所得产物为无色,由于还原性SO32->I-,故溶液中可能不含I-,也可能有I-但未反应,故溶液中一定含SO32-,由于Ba2+与SO32-不能共存,故溶液中无Ba2+;
继续滴加足量HNO3和Ba(NO3)2混合溶液,产生沉淀,此沉淀为BaSO4,沉淀经洗涤、高温干燥后质量为4.66g,即BaSO4的物质的量为0.02mol,即SO42-的物质的量为0.02mol,但由于溶液中一定含SO32-,故生成沉淀中的0.02molSO42-可能全部来自于被氧化的SO32-,也可能部分是溶液中原来含有SO42-,但SO32-和SO42-的物质的量之和必须为0.02mol;
滤液加足量NaOH溶液、加热,生成气体为NH3,即原来溶液中一定含NH4+,在标准状况下体积为1120mL,故NH4+的物质的量为0.05mol.
由于0.02molSO32-(或SO32-和SO42-)带0.04mol负电荷,而0.05molNH4+带0.05mol正电荷,而溶液要保持电中性,故溶液中一定含I-,可能含K+.
A.溶液中一定含NH4+、SO32-、I-,可能含SO42-、K+,故A错误;
B.I-一定存在,故B错误;
C.由以上分析可知溶液中一定含NH4+、SO32-、I-,故C正确;
D.另取试液滴加足量盐酸、BaCl2溶液,只能检验出溶液中含不含SO42-,对K+的存在不能确定,故D错误.
故选C.
点评 本题考查常见离子的检验,为高频考点,侧重于学生的分析、计算能力的考查,注意反应的现象以及离子的性质,易错点为碘离子的判断,注意从电荷守恒的角度分析,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
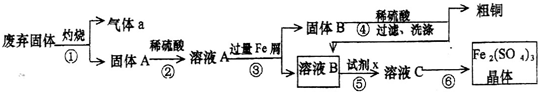
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的密度比水大 | |
| B. | 碳酸钠可用于治疗胃酸过多 | |
| C. | 钠着火可用湿布盖灭 | |
| D. | 过氧化钠露置于空气中会变成碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| B. | 2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| C. | 1.0L0.1 mol•L-1Na2S溶液中含有的S2-离子数小于0.1NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32.0% | B. | 22.0% | C. | 45.0% | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com