
 .
.分析 有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,处于ⅥA族,D的原子序数较大,故B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E是金属元素,则A为H元素,E原子序数大于S,故E为K;C原子最外层上电子数等于D原子最外层上电子数的一半,最外层电子数为3,处于ⅢA族,原子序数大于氧、小于硫,故C为Al,据此解答.
解答 解:有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,处于ⅥA族,D的原子序数较大,故B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E是金属元素,则A为H元素,E原子序数大于S,故E为K;C原子最外层上电子数等于D原子最外层上电子数的一半,最外层电子数为3,处于ⅢA族,原子序数大于氧、小于硫,故C为Al,
(1)由上述分析可知,A为H元素,B为O元素,C为Al元素,D为S元素,E为K元素,
故答案为:H;O;Al;S;K;
(2)由这五种元素组成的一种化合物的化学式为KAl(SO4)2.12H2O,该物质的一种主要用途:用作净水剂,
故答案为:KAl(SO4)2.12H2O;用作净水剂;
(3)C为Al元素,原子核外有13个电子,基态原子的电子排布式为1s22s22p63s23p1,
故答案为:1s22s22p63s23p1;
(4)D为S元素,核外电子排布式为1s22s22p63s23p4,核外电子排布图为 ,
,
故答案为: ;
;
(5)B为O元素、D为S元素,同主族自上而下电负性减小,故电负性O>S,
故答案为:O>S.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握常用几种核外电子排布,难度不大.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
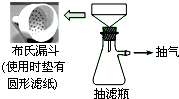 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 最高第二周期元素从左到右,正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性越强,非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.已知Y和W原子能形成两种造成酸雨的有害气体,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是W>Y>Z | |
| B. | X的氢化物没有Z的氢化物稳定 | |
| C. | 常见的Y的氢化物具有正四面体结构 | |
| D. | Y的氢化物比W的氢化物沸点高,是因为分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
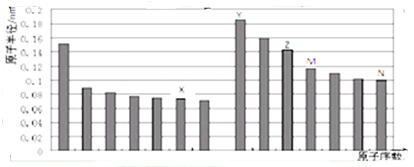
| A. | 金属性:Z>Y | |
| B. | 气态氢化物的稳定性:M>N | |
| C. | X和Y形成的化合物中可能含共价键 | |
| D. | Z元素的离子半径是本周期元素离子半径最小的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题
实验题(一)在实验室配制100mL0.5mol/L的Na2CO3溶液,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
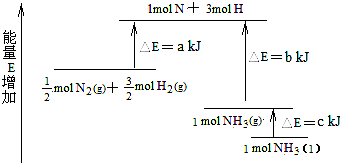
| A. | N2(g)+H2(g)=NH3(l)△H=+(b+c-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=+2(b-a)kJ•mol-1 | |
| C. | N2(g)+3H2(g)=2NH3(l)△H=-2(b+c-a)kJ•mol-1 | |
| D. | N2(g)+H2(g)=NH3(g)△H=+(a+b)kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com