
| A. | PH3 | B. | NH3 | C. | H2O | D. | CH4 |
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=3的碳酸中:c(H+)=3.0mol•L-1 | |
| B. | 饱和乙酸钠溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH为2的盐酸中:c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=13的烧碱溶液中:c(OH-)=1.0×10-1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入少量的NaHSO4溶液中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | SO2通入NaCO溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 用H2O2从酸化的海带灰浸出液中提取I2:H2O2+2I-=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 误将洁厕灵与84消毒液混合:H++Cl-+HClO=Cl2↑+H2O | |
| C. | 酸性高锰酸钾和过氧化氢制取少量氧气:2MnO4-+12H++4H2O2═4Mn2++7O2↑+10H2O | |
| D. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
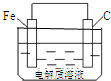 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题: .
.| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 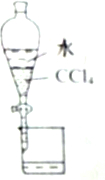 分离CCl4和水 | |
| B. |  洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. |  液体分层,下层呈无色 | |
| D. |  除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
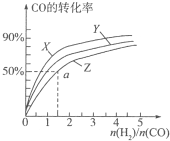 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com