
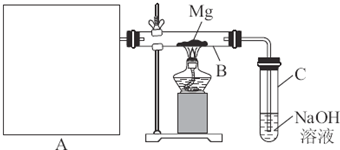
研究性学习小组进行SO2的制备及性质探究实验。
![]() (1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2??+H2O,制备SO2气体。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2??+H2O,制备SO2气体。
![]() ①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
![]()

![]() ②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
![]() (2)将SO2气体分别通入下列溶液中:
(2)将SO2气体分别通入下列溶液中:
![]() ①品红溶液,现象是 ;
①品红溶液,现象是 ;
![]() ②溴水溶液,现象是 ;
②溴水溶液,现象是 ;
![]() ③硫化钠溶液,现象是 。
③硫化钠溶液,现象是 。
![]() (3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
![]() ①原因 ,验证方法 。
①原因 ,验证方法 。
![]() ②原因 ,验证方法 。
②原因 ,验证方法 。
![]() ③原因 ,验证方法 。
③原因 ,验证方法 。
(1)①
![]() ②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
![]() (2)①溶液褪色 ② 溶液褪色 ③ 有浅黄色溶液(或溶液变浑浊)
(2)①溶液褪色 ② 溶液褪色 ③ 有浅黄色溶液(或溶液变浑浊)
![]() (3)①Na2SO3变质取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质
(3)①Na2SO3变质取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质
![]()
(1)根据反应原理和题目要求制备SO2并收集,考虑到SO2有毒等可以画出装置图。(2)SO2气体通入品红溶液品红褪色;通入溴水被氧化,溴水被还原成Br-而褪色;通入Na2S溶液因发生2S2-+SO2 +4H+![]() 3S↓+2H2O而变浅黄色浑浊。(3)因不存在气密性问题,可能原分别为①Na2SO3变质产生了Na2SO4,可用HCl和BaCl2验证。②用的不是浓H2SO4,可利用浓H2SO4的脱水性等特征验证。
3S↓+2H2O而变浅黄色浑浊。(3)因不存在气密性问题,可能原分别为①Na2SO3变质产生了Na2SO4,可用HCl和BaCl2验证。②用的不是浓H2SO4,可利用浓H2SO4的脱水性等特征验证。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
| ||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
|
| ①号试管 | ②号试管 |
| 加入药品 | 草酸溶液 硫酸酸化高锰酸钾溶液 | 草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
| 实验现象(褪色时间) | 溶液褪色很慢(30s) | 溶液褪色很快(2s) |
实验(2):在两支试管中分别加入5 mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5滴0.1mol·L-1的高锰酸钾溶液。现象如下(表2)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 现象 | 100 s | 90 s |
| 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):取3支试管分别加入5 mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1 mL、2 mL稀硫酸溶液,各加入5滴0.1 mol·L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象(表3)。
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间
实验现象 | 80 s | 100 s | 120 s |
| 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1) 该研究性学习小组的实验目的是 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫 法;
(3)实验(1)得出的结论是 。
(4)由实验(2)和实验(3)得出的结论是(写三点)
_________________________,_____________________,_______________;
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
H2C2O4+ MnO4—+ = Mn2++ + H2O
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷(带解析) 题型:实验题
S2C12是一种金黄色易挥发的液体,具有强烈的窒息性,在工业生产上可用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组进行了以下探究。 【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为
【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为 76℃、沸点为138℃。
76℃、沸点为138℃。
③ S2C12+C12 2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H
2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H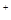 =3C12↑+3H2O 请回答下列问题:
=3C12↑+3H2O 请回答下列问题: 【实验装置设计】
【实验装置设计】

 (1)B中所放试剂为 ; C中所放试剂为 。
(1)B中所放试剂为 ; C中所放试剂为 。 (2)在加热D时温度不宜过高,其原因是 ;
(2)在加热D时温度不宜过高,其原因是 ;
为了提高S2C12的纯度,关键的操作是控制好温度和 ; (3)G装置的作用是 ;
(3)G装置的作用是 ;
(4)写出工业上制漂白粉的化学方程式 ;
查看答案和解析>>
科目:高中化学 来源:2010年广东省高二上学期期中考试化学卷 题型:填空题
向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
|
|
①号试管 |
②号试管 |
|
加入药品 |
草酸溶液 硫酸酸化高锰酸钾溶液 |
草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
|
实验现象(褪色时间) |
溶液褪色很慢(30s) |
溶液褪色很快(2s) |
实验(2):在两支试管中分别加入5 mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5滴0.1 mol·L-1的高锰酸钾溶液。现象如下(表2)
|
编号 |
①号试管 |
②号试管 |
|
褪色时间 现象 |
100 s |
90 s |
|
均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):取3支试管分别加入5 mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1 mL、2 mL稀硫酸溶液,各加入5滴0.1 mol·L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象(表3)。
|
编号 |
①号试管 |
②号试管 |
③号试管 |
|
褪色时间
实验现象 |
80 s |
100 s |
120 s |
|
均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1) 该研究性学习小组的实验目的是 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫 法;
(3)实验(1)得出的结论是 。
(4)由实验(2)和实验(3)得出的结论是(写三点)
_________________________,_____________________,_______________;
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
H2C2O4+ MnO4—+ = Mn2++ + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com