
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
(1)b a
(2)MnO2+e-+Li+===LiMnO2
(3)否 电极Li是活泼金属,能与水反应
(4)3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O 2∶1
3K2MnO4+KCl+3H2O 2∶1
[解析] (1)该电池工作时Li失去电子作负极、MnO2得到电子作正极,故外电路的电流方向是由b极流向a极。(2)电池正极上MnO2得到电子,其中+4价的Mn元素变为+3价,由此可以写出电池的正极反应式为MnO2+e-+Li+===LiMnO2。(3)由于Li易与水反应,故不能用水代替电池中的混合有机溶剂。(4) 因锰元素价态升高,故KClO3被还原为KCl,故可将方程式先写成:MnO2+KOH+KClO3―→K2MnO4+KCl,依得失电子守恒得:3MnO2+KOH+KClO4―→3K2MnO4+KCl,再根据质量守恒知KOH前应该配6,右侧还有“3H2O”。K2MnO4(Mn为+6价)在酸性溶液中歧化,生成KMnO4(锰为+7价)和MnO2(锰为+4价)。由氧化还原反应中得失电子守恒可知生成的KMnO4和MnO2的物质的量之比为2∶1。


科目:高中化学 来源: 题型:
有一瓶14%的KOH溶液,加热蒸发掉100 g 水后,变为28%的KOH溶液80 mL,该80 mL 溶液的物质的量浓度为( )
A.5 mol/L B.6 mol/L
C.6.25 mol/L D.6.75 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
关于一些重要的化学概念有下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④煤的干馏、煤的气化和液化都属于化学变化;⑤置换反应都属于离子反应。其中正确的是( )
A.①②⑤ B.①②④
C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:
Ba2++2OH-+2H++SO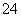 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:
2MnO +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-===PbO2+4H++SO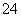
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.光催化还原水制氢比电解水制氢更节能环保、更经济
B.氨氮废水(含NH 及NH3)可用化学氧化法或电化学氧化法处理
及NH3)可用化学氧化法或电化学氧化法处理
C.某种化学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12 L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
D.向汽油中添加甲醇后,该混合燃料的热值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中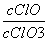 =
=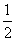
B.参加反应的氯气的物质的量等于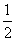 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: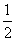 a mol≤ne≤
a mol≤ne≤ a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为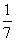 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________________________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


(a) (b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后驾车。反应的方程式为:2CrO3+3CH3CH2OH+3H2SO4===Cr2(SO4)3+3CH3CHO+6H2O 此反应的氧化剂是( )
A.H2SO4 B.CrO3
C.Cr2(SO4)3 D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 天然气 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 三氧化硫 |
| C | 胆矾 | 石灰水 | 苛性钾 | 水 | 碳酸钙 |
| D | 硫酸 | 青铜 | 氯化钠 | 氢氧化铁 | 氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com