
分析 0.6mol氯气氯气完全反应生成RCly,根据氯原子守恒列方程计算y的值;10.8gR的物质的量为0.4mol,根据M=$\frac{m}{n}$计算出R摩尔质量.
解答 解:0.6molCl2与10.8g单质R完全反应生成0.6mol RCly,
根据Cl原子守恒可得:0.6mol×2=0.4mol×y,解得:y=3;
根据R原子守恒可知10.8gR的物质的量为0.4mol,则R的摩尔质量为:M(R)=$\frac{10.8g}{0.4mol}$=27g/mol,
故答案为:3;27g/mol.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量的关系即可解答,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 称量氢氧化钠固体直接放在滤纸上称量 | |
| B. | 配制一定物质的量浓度溶液时,容量瓶中可以有水存在 | |
| C. | 酒精灯不慎碰翻着火,用湿布盖灭 | |
| D. | 不慎把浓硫酸沾在手上,立即用大量水冲洗,并涂少量碳酸氢钠稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
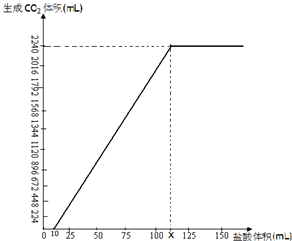 NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O→Na2CO3•nH2O(n为平均值,n≤10).取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如右图.(已知盐酸滴加至10mL时,开始产生气体,加至15mL时生成CO2112mL,溶解的CO2忽然不计)
NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O→Na2CO3•nH2O(n为平均值,n≤10).取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如右图.(已知盐酸滴加至10mL时,开始产生气体,加至15mL时生成CO2112mL,溶解的CO2忽然不计)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤、蒸馏、萃取 | B. | 溶解、过滤、结晶 | C. | 分液、溶液、萃取 | D. | 过滤、结晶、升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 | |
| 分类标准 | 金属氧化物 | 金属单质 | ||
| 不属于该类别的物质 | Cu | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2=SO32-+2HSO3-+H2O | |
| B. | CuCl2溶液与Na2S溶液2:1反应,Cu2++S2-=CuS↓ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| D. | 1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有5瓶白色固体试剂,分别是BaCl2、NaOH、Mg(OH)2、Na2CO3、BaCO3.现分别取少量试剂进行下列实验.请回答下列问题:
有5瓶白色固体试剂,分别是BaCl2、NaOH、Mg(OH)2、Na2CO3、BaCO3.现分别取少量试剂进行下列实验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com