
ĄūÓĆ“ß»ÆŃõ»Æ·“Ó¦½«SO2×Ŗ»ÆĪŖSO3ŹĒ¹¤ŅµÉĻÉś²śĮņĖįµÄ¹Ų¼ü²½Öč”£
ŅŃÖŖ£ŗSO2£Øg£©£« O2£Øg£©
O2£Øg£© SO3£Øg£© ”÷H£½£98 kJ”¤mol£1”£
SO3£Øg£© ”÷H£½£98 kJ”¤mol£1”£
£Ø1£©Ä³ĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżK£½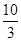 £¬ČōŌŚ“ĖĪĀ¶ČĻĀ£¬Ļņ100 LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³äČė3.0 mol SO2(g)”¢16.0 mol O2(g)ŗĶ3.0 mol SO3(g)£¬Ōņ·“Ó¦æŖŹ¼Ź±v£ØÕż£© v£ØÄę£©£ØĢī”°£¼”±”¢”°£¾”±»ņ”°£½”±£©”£
£¬ČōŌŚ“ĖĪĀ¶ČĻĀ£¬Ļņ100 LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³äČė3.0 mol SO2(g)”¢16.0 mol O2(g)ŗĶ3.0 mol SO3(g)£¬Ōņ·“Ó¦æŖŹ¼Ź±v£ØÕż£© v£ØÄę£©£ØĢī”°£¼”±”¢”°£¾”±»ņ”°£½”±£©”£
£Ø2£©Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņŅ»“ų»īČūµÄĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2.0 mol SO2ŗĶ1.0 molO2£¬“ļµ½Ę½ŗāŗóĢå»ż±äĪŖ1.6 L£¬ŌņSO2µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ ”£
£Ø3£©ŌŚ£Ø2£©ÖŠµÄ·“Ó¦“ļµ½Ę½ŗāŗó£¬øıäĻĀĮŠĢõ¼ž£¬ÄÜŹ¹SO2(g)Ę½ŗāÅØ¶Č±ČŌĄ“¼õŠ”µÄŹĒ £ØĢī×ÖÄø£©”£
| A£®±£³ÖĪĀ¶ČŗĶČŻĘ÷Ģå»ż²»±ä£¬³äČė1.0 mol O2 |
| B£®±£³ÖĪĀ¶ČŗĶČŻĘ÷ÄŚŃ¹Ēæ²»±ä£¬³äČė1.0 mol SO3 |
| C£®½µµĶĪĀ¶Č |
| D£®ŅĘ¶Æ»īČūŃ¹ĖõĘųĢå |
£Ø1£©£¾ £Ø2£©60% £Ø3£©A”¢C£Ø4£©O2£«4e££«4 H+ £½2H2O£Ø5£©16:29
½āĪöŹŌĢā·ÖĪö£ŗ(1)Ļņ100 LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬³äČė3.0 mol SO2(g)”¢16.0 mol O2(g)ŗĶ3.0 mol SO3(g)£¬æɵĆK`=9/144£¬K`£¼K£¬¹Ź·“Ó¦ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬Õż·“Ó¦ĖŁĀŹ£¾Äę·“Ó¦ĖŁĀŹ”££Ø2£©øł¾ŻSO2£Øg£©£« O2£Øg£©
O2£Øg£© SO3£Øg£©£¬Ģå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2.0 mol SO2ŗĶ1.0 molO2£¬“ļµ½Ę½ŗāŗóĢå»ż±äĪŖ1.6 L£¬æÉÖŖ·“Ó¦ŗóŃ¹Ēæ±äĪŖŌĄ“µÄ1.6L/2L=80%£¬¹Ź·“Ó¦ŗóµÄ×ÜĪļÖŹµÄĮæĪŖ£Ø2+1£©”Į80%=2.4mol”£
SO3£Øg£©£¬Ģå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ³äČė2.0 mol SO2ŗĶ1.0 molO2£¬“ļµ½Ę½ŗāŗóĢå»ż±äĪŖ1.6 L£¬æÉÖŖ·“Ó¦ŗóŃ¹Ēæ±äĪŖŌĄ“µÄ1.6L/2L=80%£¬¹Ź·“Ó¦ŗóµÄ×ÜĪļÖŹµÄĮæĪŖ£Ø2+1£©”Į80%=2.4mol”£
SO2£Øg£©£« O2£Øg£©
O2£Øg£© SO3£Øg£©
SO3£Øg£©
ĘšŹ¼ 2mol 1mol 0mol
·“Ó¦ 2a a 2a
ÖÕĮĖ 2-2a 1-a 2a ¹Ź(2-2a)+(1-a)+2a="2.4mol" Ōņa=0.6mol”£¹ŹSO2µÄ×Ŗ»ÆĀŹĪŖ£Ø2-2”Į0.6£©mol/2mol”Į100%=60%
£Ø3£©AŃ”Ļī£¬¼ÓČė·“Ó¦ĪļŃõĘų£¬·“Ó¦ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬SO2ÅØ¶Č½µµĶ”£BŃ”Ļī£¬¼ÓČėSO2£¬·“Ó¦ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬µ«SO2×Ŗ»ÆĀŹ½µµĶ£¬ÅضČÉżøß”£CŃ”Ļī£¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬½µµĶĪĀ¶Č£¬ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬SO2ÅØ¶Č½µµĶ”£DŃ”Ļī£¬»īČūŃ¹ĖõĢå»ż£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬µ«Ģå»ż¼õŠ”£¬ÅضČŌö“󔣹ŹŃ”ŌńA”¢CŃ”Ļī”££Ø4£©O2£«4e££«4 H+ £½2H2O£Ø5£©øĆ·“Ó¦µÄ×Ü·“Ó¦·½³ĢŹ½Ó¦ĪŖ2SO2+O2+2H2O=2H2SO4£¬Éč¼ÓČėSO2µÄĪļÖŹµÄĮæĪŖa£¬¼ÓČėH2OµÄĪļÖŹµÄĮæĪŖb¹Ź =0.5£¬¹Źa£ŗb=9£ŗ58”£Ōņ¶žÕßµÄÖŹĮæÖ®±ČĪŖ16:29”£
=0.5£¬¹Źa£ŗb=9£ŗ58”£Ōņ¶žÕßµÄÖŹĮæÖ®±ČĪŖ16:29”£
æ¼µć£ŗ»ÆŃ§Ę½ŗā³£ŹżµÄŗ¬Ņ壻µē¼«·“Ó¦ŗĶµē³Ų·“Ó¦·½³ĢŹ½£»»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ ”£


 ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø
ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø ³å“Ģ100·Öµ„ŌŖÓÅ»ÆĮ·æ¼¾ķĻµĮŠ“š°ø
³å“Ģ100·Öµ„ŌŖÓÅ»ÆĮ·æ¼¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¼×“¼ŹĒÖŲŅŖµÄ»Æѧ¹¤Ņµ»ł“”ŌĮĻŗĶĒå½ąŅŗĢåČ¼ĮĻ”£¹¤ŅµÉĻæÉĄūÓĆCO»ņCO2Ą“Éś²śČ¼ĮĻ¼×“¼”£ŅŃÖŖ¼×“¼ÖʱøµÄÓŠ¹Ų»Æѧ·“Ó¦ŅŌ¼°ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄ»Æѧ·“Ó¦Ę½ŗā³£ŹżČēĻĀ±ķĖłŹ¾£ŗ
£Ø1£©·“Ó¦¢ŚŹĒ £ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
£Ø2£©Ä³ĪĀ¶ČĻĀ·“Ó¦¢ŁÖŠH2µÄĘ½ŗā×Ŗ»ÆĀŹ£Øa£©ÓėĢåĻµ×ÜŃ¹Ēæ(P)µÄ¹ŲĻµ£¬ČēĶ¼ĖłŹ¾”£ŌņĘ½ŗāדĢ¬ÓÉA±äµ½BŹ±£¬Ę½ŗā³£ŹżK(A) K(B)£ØĢī”°£¾”±”¢”°£¼”±»ņ”°£½”±£©”£¾Ż·“Ó¦¢ŁÓė¢ŚæÉĶʵ¼³öK1”¢K2ÓėK3Ö®¼äµÄ¹ŲĻµ£¬ŌņK3= £ØÓĆK1”¢K2±ķŹ¾£©”£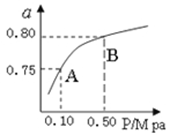
£Ø3£©ŌŚ3 LČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦¢Ś£¬ŅŃÖŖc(CO)Óė·“Ó¦Ź±¼ät±ä»ÆĒśĻߢńČēĶ¼ĖłŹ¾£¬ČōŌŚt0Ź±æĢ·Ö±šøıäŅ»øöĢõ¼ž£¬ĒśĻߢń±äĪŖĒśĻߢņŗĶĒśĻߢó”£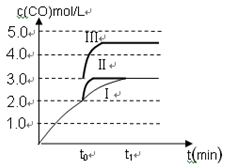
µ±ĒśĻߢń±äĪŖĒśĻߢņŹ±£¬øıäµÄĢõ¼žŹĒ ”£
µ±ĒśĻߢń±äĪŖĒśĻß¢óŹ±£¬øıäµÄĢõ¼žŹĒ ”£
£Ø4£©¼×“¼Č¼ĮĻµē³Ųӊ׏ć·ŗµÄÓĆĶ¾£¬Ķ¬Ź±Al-AgOµē³ŲŹĒÓ¦ÓĆ¹ć·ŗµÄÓćĄ×µē ³Ų£¬ĘäŌĄķČēĶ¼ĖłŹ¾”£øƵē³ŲµÄøŗ¼«·“Ó¦Ź½ŹĒ ”£
£Ø5£©Ņ»¶ØĢõ¼žĻĀ¼×“¼ÓėŅ»Ńõ»ÆĢ¼·“Ó¦æÉŅŌŗĻ³ÉŅŅĖį”£Ķس£×“æöĻĀ£¬½«a mol/LµÄ“×ĖįÓėb mol/LBa(OH)2ČÜŅŗµČĢå»ż»ģŗĻ£¬·“Ó¦Ę½ŗāŹ±£¬2c(Ba2£«)= c(CH3COO£)£¬ÓĆŗ¬aŗĶbµÄ“śŹżŹ½±ķŹ¾øĆ»ģŗĻČÜŅŗÖŠ“×ĖįµÄµēĄė³£ŹżĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
“óĘų¹ĢµŖŗĶŗĻ³ÉµŖŹĒÖܵŖµÄÖŲŅŖŠĪŹ½”£ĻĀ±ķŹĒ“óĘų¹ĢµŖŗĶŗĻ³É°±µÄ²æ·ÖKÖµ£ŗ
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| ĪĀ¶Č | 25”ę | 2000”ę | 25”ę | 400”ę |
| Ę½ŗā³£ŹżK | 3.84”Į10-31 | 0.1 | 5”Į108 | 200 |
 Cu(NH3)2AC”¤CO(aq)+Q(Q>0)
Cu(NH3)2AC”¤CO(aq)+Q(Q>0) NH4++NH2-”£
NH4++NH2-”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚ450”ę²¢ÓŠ“߻ƼĮ“ęŌŚĻĀ£¬ŌŚĢå»żĪŖ1LµÄĆܱÕŗćĪĀČŻĘ÷ÖŠ£¬¶žŃõ»ÆĮņŗĶŃõĘų·¢ÉśČēĻĀ·“Ó¦£ŗ2SO2+O2 2SO3
2SO3
£Ø1£©ŅŃÖŖ£ŗ64g SO2ĶźČ«×Ŗ»ÆĪŖSO3»į·Å³ö85kJČČĮ攣SO2×Ŗ»ÆĪŖSO3µÄČČ»Æѧ·½³ĢŹ½ŹĒ ”£
£Ø2£©øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½K= ”£
£Ø3£©½µµĶĪĀ¶Č£¬»Æѧ·“Ó¦ĖŁ¶Č ”£øĆ·“Ó¦KÖµ½« ”£Ń¹Ē潫 ”££ØĢī”°Ōö“ó”±»ņ”°¼õŠ””±»ņ”°²»±ä”±£©
£Ø4£©450”ꏱ£¬ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ£¬½«¶žŃõ»ÆĮņÓėŃõĘų»ģŗĻ£¬·“Ó¦¹ż³ĢÖŠSO2”¢O2”¢SO3ĪļÖŹµÄĮæ±ä»ÆČēĶ¼£¬·“Ó¦“¦ÓŚĘ½ŗāדĢ¬µÄŹ±¼ä¶ĪŹĒ ”£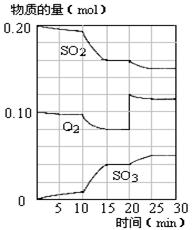
a£®10-15min b£®15-20min c£®20-25min d£®25-30min
£Ø5£©¾ŻĶ¼ÅŠ¶Ļ£¬10minµ½15minµÄĒśĻß±ä»ÆµÄŌŅņæÉÄÜŹĒ £ØĢīŠ“±ąŗÅ£©”£
a£®Ōö¼ÓSO3µÄĪļÖŹµÄĮæ b£®ĖõŠ”ČŻĘ÷Ģå»ż c£®½µµĶĪĀ¶Č d.“߻ƼĮ
£Ø6£©ŌŚ15·ÖÖÓŹ±£¬SO2µÄ×Ŗ»ÆĀŹŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚŅ»¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠ»Æѧ·“Ó¦CO2 (g)+H2 (g) CO (g)+H2O (g)£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKŗĶĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
CO (g)+H2O (g)£¬Ęä»ÆŃ§Ę½ŗā³£ŹżKŗĶĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
| t / ”ę | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ijĪĀ¶ČĻĀ£¬½«2mol AŗĶ2.8 mol B³äČėĢå»żĪŖ2 LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗ
aA£Øg£©+B£Øg£© 2C£Øg£©+ D£Øs£© £¬5 minŗó“ļµ½Ę½ŗā”£Ę½ŗāŹ±AĪŖ1.6mol£¬·Å³öµÄČČĮæĪŖQ”£ŌŚt0Ź±æĢ£¬Čō“ÓĘ½ŗāĢåĻµÖŠ·ÖĄė³öĖÄ·ÖÖ®Ņ»µÄ»ģŗĻĘųĢ壬ŠĀĘ½ŗāĢåĻµÖŠc(A)ĪŖ0.6mol£ÆL”£
2C£Øg£©+ D£Øs£© £¬5 minŗó“ļµ½Ę½ŗā”£Ę½ŗāŹ±AĪŖ1.6mol£¬·Å³öµÄČČĮæĪŖQ”£ŌŚt0Ź±æĢ£¬Čō“ÓĘ½ŗāĢåĻµÖŠ·ÖĄė³öĖÄ·ÖÖ®Ņ»µÄ»ģŗĻĘųĢ壬ŠĀĘ½ŗāĢåĻµÖŠc(A)ĪŖ0.6mol£ÆL”£
£Ø1£© 5 minÄŚÓĆB±ķŹ¾øĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ ”£
£Ø2£©øĆĪĀ¶ČĻĀ£¬“ĖæÉÄę·“Ó¦µÄÄę·“Ó¦µÄĘ½ŗā³£ŹżĪŖ ”£
£Ø3£©aµÄÖµĪŖ ”£
£Ø4£©ĻĀĮŠĖµ·ØŅ»¶ØÄÜĖµĆ÷ÉĻŹö·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ ”£
¢Łµ„Ī»Ź±¼äĄļĆæÉś³É1molBµÄĶ¬Ź±ĻūŗÄĮĖ2molµÄC ¢ŚDµÄĪļÖŹµÄĮæ²»ŌŁ±ä»Æ
¢Ū»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ±ä»Æ ¢Ü»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ
¢ŻĢåĻµµÄŃ¹Ēæ²»ŌŁ±ä»Æ
£Ø5£©øĆĪĀ¶ČĻĀ£¬Ä³Ķ¬Ń§Éč¼ĘĮĖŅŌĻĀŹµŃ飬ĒėŌŚæÕøńÖŠĢīČėČČĮæ£Øŗ¬QµÄ±ķ“ļŹ½±ķŹ¾£©
| ĘšŹ¼ n£ØA£©/mol | ĘšŹ¼ n£ØB£©/mol | ĘšŹ¼ n£ØC£©/mol | ĘšŹ¼ n£ØD£©/mol | “ļµ½Ę½ŗāŹ±·Å³ö£Ø»ņĪüŹÕ£©µÄČČĮæ |
| 0 | 1.6 | 8 | ×ćĮæ | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
øßĀÆĮ¶Ģś¹ż³ĢÖŠ·¢ÉśµÄÖ÷ŅŖ·“Ó¦ĪŖ1/3Fe2O3(s) + CO(g) 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
ŅŃÖŖøĆ·“Ó¦ŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżČēĻĀ£ŗ
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½K=_____________£¬”÷H________0(Ģī”°>”±”¢”°<”±»ņ”°=”±)£»
£Ø2£©ŌŚŅ»øöČŻ»żĪŖ10LµÄĆܱÕČŻĘ÷ÖŠ£¬1000”ꏱ¼ÓČėFe”¢Fe2O3”¢CO”¢CO2ø÷1£®0 mol£¬·“Ó¦¾¹żl0 min“ļµ½Ę½ŗā”£ĒóøĆŹ±¼ä·¶Ī§ÄŚ·“Ó¦µÄĘ½¾ł·“Ó¦ĖŁĀŹ¦Ō(CO2)=" _________" ”¢COµÄĘ½ŗā×Ŗ»ÆĀŹ= _____________£ŗ
£Ø3£©ÓūĢįøߣØ2£©ÖŠCOµÄĘ½ŗā×Ŗ»ÆĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ_____________”£
| A£®¼õÉŁFeµÄĮæ |
| B£®Ōö¼ÓFe203µÄĮæ |
| C£®ŅĘ³ö²æ·ÖCO2 |
| D£®Ģįøß·“Ó¦ĪĀ¶Č |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¹¤ŅµÖĘĻõĖįµÄÖ÷ŅŖ·“Ó¦ŹĒ£ŗ4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ¦¤H=" -1025" KJ/mol
4NO(g)+6H2O (g) ¦¤H=" -1025" KJ/mol
£Ø1£©Ņ»¶ØĪĀ¶ČĻĀ£¬ĻÖ½«0.8mol NH3ŗĶ1.5mol O2³äČėŅ»ŗćŃ¹ĆܱÕČŻĘ÷ÖŠ£¬ĻĀĮŠŹ¾ŅāĶ¼ÕżČ·ĒŅÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ 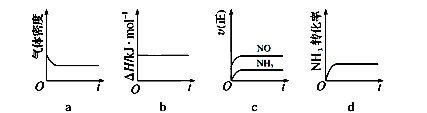
£Ø2£©ŌŚČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬ČŻĘ÷ÄŚ²æ·ÖĪļÖŹµÄĪļÖŹµÄĮæÅضČČēĻĀ±ķ£ŗ
| Ź±¼ä£ÆÅØ¶Č | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| ĘšŹ¼ | 0.8 | 1.5 | 0 |
| µŚ2min | 0.7 | a | 0.1 |
| µŚ4min | 0.4 | 1.0 | 0.4 |
| µŚ6min | 0.4 | 1.0 | 0.4 |
| µŚ8min | 1.2 | 2.5 | 0.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
µā¼°Ęä»ÆŗĻĪļŌŚČĖĄą»ī¶ÆÖŠÕ¼ÓŠÖŲŅŖµŲĪ»”£
(1)¼ÓµāŹ³ŃĪÖŠŗ¬ÓŠµāĖį¼Ų(KIO3)£¬¹¤ŅµÉĻŅŌµē½ā·ØÖʱøµāĖį¼Ų£¬µē½āÉč±øČēĶ¼ĖłŹ¾”£ĻČ½«Ņ»¶ØĮæµÄµāČÜÓŚ¹żĮæĒāŃõ»Æ¼ŲČÜŅŗ£¬·¢Éś·“Ó¦£ŗ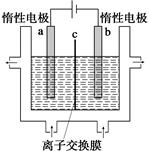
3I2£«6KOH=5KI£«KIO3£«3H2O£¬ŌŁ½«øĆČÜŅŗ¼ÓČė (Ņõ¼«”¢Ńō¼«)Ēų£¬Įķ½«ĒāŃõ»Æ¼ŲČÜŅŗ¼ÓČėĮķĶāŅ»øöĒų”£Ź¹ÓĆ (Ņõ”¢Ńō)Ąė×Ó½»»»Ä¤£¬ŌŚŃō¼«·¢ÉśµÄµē¼«·“Ó¦Ź½£ŗ ”£
(2)µā»ÆĒā²»ĪČ¶Ø£¬·Ö½ā·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ2HI(g) I2(g)+H2(g) ¦¤H="+9.48" kJ”¤mol£1ŅŃÖŖ¦¤S£¾0
I2(g)+H2(g) ¦¤H="+9.48" kJ”¤mol£1ŅŃÖŖ¦¤S£¾0
¢ŁøĆ·“Ó¦ŹōÓŚ( )
A£®ČĪŗĪĪĀ¶Č¾ł×Ō·¢ B£®ČĪŗĪĪĀ¶Č¾ł²»×Ō·¢ C£®øßĪĀ×Ō·¢ D£®µĶĪĀ×Ō·¢
¢ŚŅ»¶ØĢõ¼žĻĀ£¬·“Ó¦ŌŚŅ»øö“ųÓŠ»īČūµÄĆܱÕČŻĘ÷ÖŠ“ļµ½Ę½ŗā£¬ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ( )
A£®ŗćĪĀ£¬ĖõŠ”Ģå»ż£¬Ę½ŗā³£Źż²»±ä
B£®ŗćĪĀ£¬ĖõŠ”Ģå»ż£¬Ę½ŗā²»ŅĘ¶Æ£¬ŃÕÉ«¼ÓÉī
C£®ŗćČŻ£¬ÉżĪĀ£¬ÕżĻņ·“Ó¦ĖŁĀŹŗĶÄęĻņ·“Ó¦ĖŁĀŹ¾łŌö“ó
D£®ŗćČŻ£¬ŌŚČŻĘ÷ÖŠČōĶ¶Čė2mol HI£¬“ļµ½Ę½ŗāŹ±ĪüŹÕ9.48 kJ µÄČČĮæ
¢ŪŅ»¶ØĪĀ¶ČĻĀ£¬Ę½ŗā³£ŹżK=1/4£¬ŌŚ2LµÄČŻĘ÷ÖŠ£¬¼ÓČė4molHI·¢Éś·“Ó¦“ļµ½Ę½ŗā£¬HIµÄ×Ŗ»ÆĀŹ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com