
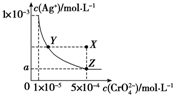
| A. | T℃时,在Y点和Z点,Ag2CrO4的Ksp相等 | |
| B. | 向饱和AgCrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点 | |
| C. | T℃时,Ag2CrO4的Ksp为1×10-8 | |
| D. | 图中a=$\sqrt{2}$×10-4 |
分析 A、一定温度下溶度积是常数,随温度变化,不随浓度变化;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
C、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
D、溶度积常数不变,依据溶液中Z点时离子浓度计算;
解答 解:A、一定温度下溶度积是常数,随温度变化,不随浓度变化,所以t℃时,Y点和Z点时Ag2CrO4的Ksp相等,故A正确;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B正确;
C、依据 图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag++CrO42-;
Ksp=c2(Ag+)•c(CrO42-)=(10-3)2×10-5=10-11;故C错误;
D、依据溶度积常数计算Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42-)=1×10-11,Z点时c(CrO42-)=5×10-4,则c(Ag+)2=2×10-8,所以a=$\sqrt{2}$×10-4,故D正确;
故选C.
点评 本题考查了沉淀溶解平衡的分析判断,溶度积常数的计算应用,注意溶度积只随温度变化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | b L | B. | (b-a)L | C. | (2a-b)L | D. | (2b-a)L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 外接负载时,左槽作为原电池负极,发生氧化反应 | |
| B. | 外接电源时,左槽连接外接电源的正极,发生还原反应 | |
| C. | 负载是镀铜的电镀槽时,H+由左槽向右槽移动 | |
| D. | 充电时若转移电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a×(A-N+m)/(A+m)mol | B. | a×(A-N)/Amol | C. | a×(A-N)/(A+m)mol | D. | a×(A-N+m)/Amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2的电子式为 | |
| B. | 16g甲烷完全燃烧生成的CO2为11.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为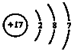 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com