

| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
分析 生成可燃性气体,说明发生反应:Fe+H2SO4=FeSO4+H2↑,得到的溶液只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,根据Cu的质量计算CuO质量,进而计算Fe的质量,根据电子转移计算生成氢气的质量,根据硫酸根守恒可知n反应(H2SO4)=n(FeSO4),再由Fe原子守恒可知n反应(H2SO4)=n(FeSO4)=n(Fe),据此分析解答.
解答 解:生成可燃性气体,说明发生反应:Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,生成1.28gCu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.02mol,故混合物中m(CuO)=0.02mol×80g/mol=1.6g,则m(Fe)=8.32g-1.6g=6.72g,n(Fe)=$\frac{6.72g}{56g/mol}$=0.12mol,
A.令氢气的物质的量为nmol,根据电子转移守恒,由2n+0.02mol×2=0.12mol×2,解得n=0.1mol,故氢气的质量=0.1mol×2g/mol=0.2g,故A正确;
B.通过以上分析知,Fe的质量分数=$\frac{6.72g}{8.32g}$×100%=80.77%,故B错误;
C.根据硫酸根守恒可知n反应(H2SO4)=n(FeSO4),再由Fe原子守恒,可知n反应(H2SO4)=n(FeSO4)=n(Fe)=0.12mol,故C错误;
D.溶液中金属离子是亚铁离子,根据Fe原子守恒得n(Fe2+)=n(Fe)=0.12mol,故D错误;
故选A.
点评 本题考查混合物的计算,为高频考点,侧重考查学生分析判断能力,明确物质之间反应及反应先后顺序是解本题关键,注意原子守恒、转移电子守恒的灵活运用,题目难度不大.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
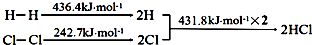
| A. | H-H键比Cl-Cl键稳定 | |
| B. | △H=-184.5 kJ•mol-1 | |
| C. | 正反应活化能比逆反应活化能高 | |
| D. | 在相同条件下,1mol H2(g)和1mol Cl2(g)分别在点燃和光照条件下反应生成2mol HCl(g),重新恢复到原来的状态时△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
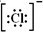 ;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.
;SO3的沸点为44.8℃,其汽化时需克服的作用力是分子间作用力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(H+)=c(OH-)+c(NH3•H2O) | ||
| C. | c(SO42-)+c(OH-)=c(NH4+)+c(Fe2+)+c(H+) | D. | c(NH3•H2O)+c(NH4+)=0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
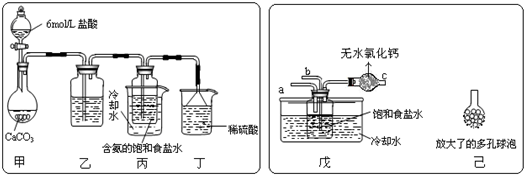
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
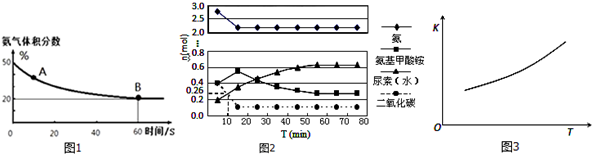
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
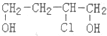 )是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂.
)是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂.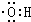 .
.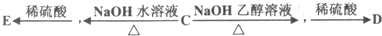
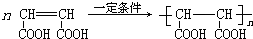 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com