
 ,名称是乙烯.
,名称是乙烯. ,名称是聚乙烯.
,名称是聚乙烯.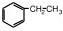 、
、 .
. .属于取代反应反应类型.
.属于取代反应反应类型. 分析 (1)取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g,可知n(H):n(C)=$\frac{7.2g}{18g/mol}$:$\frac{17.6g}{44g/mol}$=2:1,该烃(气体)的密度是同种情况下氢气的14倍,M为28g/mol,则该烃为CH2=CH2;
(2)芳香烃的分子式为C8H10,若为 苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
邻二甲苯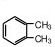 的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
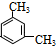
对二甲苯 的苯环上有1种不同氢原子,所以苯环上的一溴取代物只有1种;
的苯环上有1种不同氢原子,所以苯环上的一溴取代物只有1种;
间二甲苯 的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种;
的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种;
①苯环上的一氯取代物有3种,为乙苯或间二甲苯;
②光照条件下侧链上H发生取代反应;
③苯与液溴发生取代反应生成溴苯.
解答 解:(1)取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g,可知n(H):n(C)=$\frac{7.2g}{18g/mol}$:$\frac{17.6g}{44g/mol}$=2:1,该烃(气体)的密度是同种情况下氢气的14倍,M为28g/mol,则该烃为CH2=CH2,
①该烃的电子式为 ,名称是乙烯,故答案为:
,名称是乙烯,故答案为: ;乙烯;
;乙烯;
②0.1mol该烃能与0.1mol×160g/mol=16g克溴起加成反应;加成产物需0.4mol溴蒸汽完全取代,故答案为:16;0.4;
③该塑料的结构简式是 ,名称是聚乙烯,故答案为:
,名称是聚乙烯,故答案为: ;聚乙烯;
;聚乙烯;
(2)①苯环上的一氯取代物有3种,为乙苯或间二甲苯,结构简式为 、
、 ,故答案为:
,故答案为: ;
; ;
;
②光照条件下侧链上H发生取代反应,则使上述芳香烃与氯的取代反应发生在支链上,采用的反应条件是光照,故答案为:光照;
③苯与液溴发生取代反应生成溴苯,该反应为 ,属于取代反应,
,属于取代反应,
故答案为: ;取代反应.
;取代反应.
点评 本题考查有机物的推断,为高频考点,把握有机物的结构、燃烧法确定分子式为解答的关键,侧重分析与应用能力的考查,注意有机物的同分异构体应用,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3过量 | B. | Na2CO3恰好与醋酸完全反应 | ||
| C. | 两种酸都过量 | D. | 两种酸的物质的量浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃的酒精灯不小心打碎了,可直接用自来水灭火 | |
| B. | 点燃氢气前先验纯 | |
| C. | 蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却 | |
| D. | 在实验室可以用口尝来鉴别化学药品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在滴加过程中,Kw始终保持不变 | |
| B. | 25℃时,反应后溶液中c(NH4+)>c(CH3COO-) | |
| C. | 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂 | |
| D. | 25℃时,反应NH4++H2O?NH3•H2O+H+的平衡常数约为5.6×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com