
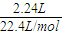 ×3=0.3mol,再加上空气中氧气得的电子,那么整个过程中得电子数肯定大于0.3 mol,故金属失去的电子数也大于0.3mol;由于金属阳离子电荷总数等于金属离子结合的OH-,即n(e-)=n(OH-),所以最终沉淀质量大于4.9+0.3×17=10g.
×3=0.3mol,再加上空气中氧气得的电子,那么整个过程中得电子数肯定大于0.3 mol,故金属失去的电子数也大于0.3mol;由于金属阳离子电荷总数等于金属离子结合的OH-,即n(e-)=n(OH-),所以最终沉淀质量大于4.9+0.3×17=10g.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.9克Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是 ( )
A. 6g B. 8g C. 10g D. 10.2g
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.6g | B.8g | C.10g | D.10.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com