
【题目】有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
3A(g)+B(g)2C(g)+D(g)
(1)达平衡时,a中A的浓度为M molL﹣1 , C的浓度为N molL﹣1 , b中A的浓度为m molL﹣1 , C的浓度为n molL﹣1 , 则Mm;Nn; (填“>”或“<”或“=”或“无法比较”)
(2)保持温度不变,按下列配比分别充入 a、b 两容器,达平衡后a中C的浓度为N molL﹣1的是 , b中C的浓度为n molL﹣1的是
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1mol D
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD
(3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为WmolL﹣1 , C的浓度为YmolL﹣1 , 则W和M,Y和N之间的关系为WM、YN. (填>、<、=、无法比较)
(4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为R molL﹣1 , 则关系式正确的是
A.R=2M
B.R<M
C.M<R<2M
D.R>2M
【答案】
(1)<;<
(2)DE;ADE
(3)>;<
(4)C
【解析】解:(1)a保持容积不变,b保持内外压强相等,反应3A(g)+B(g)2C(g)+D(g)是气体物质的量减少的反应,平衡时a中压强比b中小,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故b中平衡时A的浓度大于a中A的平衡浓度,即M<m,平衡右移,b中C的平衡浓度高于a中C的平衡浓度,即N<n,
所以答案是:<;<;(2)改变起始投料比,要想达到平衡后a中C的浓度仍为N molL﹣1 , 恒温恒容下,与原平衡是完全等效平衡,按化学计量数转化到方程式左边,满足与原平衡中相同物质的起始投料量相等,选项中DE符合;
b中C的浓度为n molL﹣1 , 与原平衡为等效平衡,等温等压的条件下,按化学计量数转化到方程式左边,满足与原平衡中物质的投料量比,选项中ADE符合,
所以答案是:DE;ADE;(3)若将2molC和2molD充入a中,等效为开始投入3molA(g)、1molB(g)、1molD(g),与原平衡相比平衡逆向移动,故平衡时A的浓度增大,C的浓度减小,即W>M、Y<N,
所以答案是:>;<;(4)将4mol C和2 mol D充入a中相当于开始充入6 mol A+2 mol B,压强增大,平衡向右移动,反应物转化率增大,参加反应的A的物质的量大于原平衡的2倍,平衡时A的浓度小于原平衡的2倍,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故M<R<2M,
所以答案是:C.
【考点精析】掌握化学平衡状态本质及特征和等效平衡是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);在条件不变时,可逆反应不论采取何种途径,即由正反应开始或由逆反应开始,最后所处的平衡状态是相同;一次投料或分步投料,最后所处平衡状态是相同的,某一可逆反应的平衡状态只与反应条件(物质的量浓度、温度、压强或体积)有关,而与反应途径(正向或逆向)无关.


科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-,△H>0,下列叙述正确的是( )
H++OH-,△H>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw不变,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 可以通过电解熔融AlCl3来冶炼铝
B. HF的稳定性很强,是因为其分子间能形成氢键
C. 非极性键不只存在于双原子单质分子中
D. 分解反应都是吸热反应,化合反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
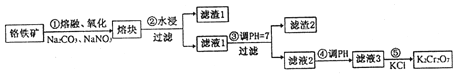
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是______。
(2)滤渣1中含量最多的金属元素是_________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是______(用离子方程式表示)。
(4)某工厂用76 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品41.16kg,则产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列的说法正确的是 ( )
A. 甲烷和乙烯互为同系物
B. 葡萄糖和蔗糖不是同分异构体,但属于同系物
C. 糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D. 油脂在酸性条件下水解为丙三醇和高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常见物质,利用这些物质能完成的实验是
①白酒中是否含甲醇 ②鉴别食盐和小苏打 ③蛋壳能否溶于酸( )
A. ①② B. ①③ C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述错误的是
A.HNO3受热分解可生成NO2
B.Na在O2中燃烧可生成Na2O2
C.CaCl2暴露在空气中可生成CaCO3
D.向FeCl3溶液中滴加KSCN溶液,溶液显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)═2H2O(1)△H=﹣285.8kJ/mol
B.2H2(g)+O2(g)═2H2O(1)△H=+571.6kJ/mol
C.2H2(g)+O2(g)═2H2O(g)△H=﹣571.6kJ/mol
D.H2(g)+ ![]() O2(g)═H2O(1)△H=﹣285.8kJ/mol
O2(g)═H2O(1)△H=﹣285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com