
【题目】将1.8g碳置于2.24L(标准状况)O2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O2(g)=CO2(g)△H=﹣393.0kJmol-1综合上述信息,请写出CO完全燃烧的热化学方程式__________________________。
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)![]() COCl2(g)△H<0制备。如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线(图中Cl2的起始浓度为1.2mol/L,CO的起始浓度为1.0mol/L)。回答下列问题:
COCl2(g)△H<0制备。如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线(图中Cl2的起始浓度为1.2mol/L,CO的起始浓度为1.0mol/L)。回答下列问题:

①若保持温度不变,在第8min加入体系中的三种物质个1mol,则平衡____________移动(填“向反应正方向”、“向逆反应方向”或“不”);
②若将初始投料浓度变为c(Cl2)=0.8mol/L、c(CO)=0.6mol/L、c(COCl2)=____________mol/L,保持反应温度不变则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
③比较第8秒反应温度T(8)与第15min反应温度T(15)的高低:T(8) T(15)(填“<”、“>”、或“=”)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①已知一定条件下,该反应中CO2的平衡转化率随温度、投料比 [![]() ]的变化曲线如图2:在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比[
]的变化曲线如图2:在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比[![]() ]变化的曲线图:
]变化的曲线图:

(4)常温下,将 a mol·L -1的醋酸 与 b mol·L -1 Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在 2c(Ba 2+)=c(CH3COO-),则混合溶液中醋酸的电离常数 Ka=______________(含a和b的代数式表示)
【答案】(1)2CO(g)+O2(g)=2CO2(g)△H=﹣566kJmol﹣1。(2分)
(2)①向正反应方向(2分)②0.4(2分)③<(2分)
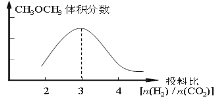
(3)① (0点开始1分,3这点最高1分)
(0点开始1分,3这点最高1分)
②CH3OCH3-12e-+16OH-=2CO32-+11H2O(2分)(4)![]() (2分)
(2分)
【解析】
试题分析:(1)1.8g碳的物质的量是1.8g÷12g/mol=0.15mol,2.24L(标准状况)O2的物质的量是0.1mol,二者充分燃烧,至全部反应物耗尽,设生成CO和CO2的物质的量分别是xmol和ymol,则x+y=0.15、x+2y=0.2,解得x=0.1,y=0.05。已知:C(s)+O2(g)![]() CO2 (g) △H=-393.0 kJ·mol—1,所以如果完全转化为二氧化碳放出的热量是0.15mol×393.0kJ/mol=58.95kJ。由于测得放出热量30.65 kJ,这说明生成0.1molCO继续燃烧可以放出的热量是58.95kJ-30.65kJ=28.3kJ,1molCO完全燃烧放出的热量是283kJ,则热化学方程式为2CO (g)+O2(g) =2CO2 (g) ΔH=-566kJ·mol-1。
CO2 (g) △H=-393.0 kJ·mol—1,所以如果完全转化为二氧化碳放出的热量是0.15mol×393.0kJ/mol=58.95kJ。由于测得放出热量30.65 kJ,这说明生成0.1molCO继续燃烧可以放出的热量是58.95kJ-30.65kJ=28.3kJ,1molCO完全燃烧放出的热量是283kJ,则热化学方程式为2CO (g)+O2(g) =2CO2 (g) ΔH=-566kJ·mol-1。
(2)①若保持温度不变,在第8 min 加入体系中的三种物质各1 mol,则相当于是增大压强,平衡向正反应方向移动;
②保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同,说明是等效平衡,则在温度和容积不变的条件下要满足投料比与最初的相同。设光气的浓度是xmol/L,则根据根据方程式可知相当于是起始物质的浓度为氯气:0.8+x,CO:0.6+x,所以有![]() ,解得x=0.4。
,解得x=0.4。
③根据图像可知第8min时反应物浓度大于第15min时反应物浓度,而生成物浓度小于第15min时反应物浓度,这说明平衡常数减小。由于正方应是放热反应,则改变的条件是升高温度,所以第8 min反应温度T(8)小于第15 min反应温度T(15)。
(3)由方程式可知,投料比为3时,两者的转化率相同,二甲醚的体积分数最大,因此平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图可表示为
②二甲醚酸性介质燃料电池的负极应该通入二甲醚,发生失去电子的氧化反应,则电极反应式为CH3OCH3-12e-+3H2O=2CO2↑+12H+。
(4)反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH-)=10-7mol/L,溶液中醋酸的浓度是(0.5a-b)mol/L,则醋酸电离平衡常数K=![]() =
=![]() ×10-7。
×10-7。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
pC(g),达到平衡后,温度不变,将气体体积压缩到1/2,当达到平衡时C的浓度为原来的1.9倍,则下列叙述正确的是( )
A. m+n>p B. A的转化率增加
C. 平衡向逆反应方向移动 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法中,不正确的是
A. 胶体、溶液、浊液的分类依据是分散质微粒直径大小
B. “卤水点豆腐”、“黄河入海口处的沙洲”都与胶体的聚沉有关
C. 向 1 molL﹣1氯化铁溶液中加入少量的 NaOH 溶液制取氢氧化铁胶体
D. 可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③恒容时容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用现有三组溶液:①汽油和氯化钠溶液 ②汽油和柴油的混合物 ③从氯化钠和单质碘的水溶液中分离出碘,分离以上物质正确方法依次是( )
A.分液、蒸馏、萃取
B.萃取、蒸发、分液
C.分液、萃取、蒸馏
D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会发展密切相关。下列措施不利于节能减排、保护环境的是
A. 研发易降解的生物农药,减少农药的残余量
B. 推广使用节能环保材料,减少有害物质对环境的污染
C. 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
D. 研究采煤、采油新技术,提高产量以满足工业生产的快速发展
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com