


分析 铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加硫酸铵焙烧,Fe2O3转化为NH4Fe(SO4)2同时生成氨气,则气体I为氨气,固体II加水溶解、过滤,滤渣为SiO2和Al2O3,操作①为溶解、过滤,用焦炭在高温条件下还原SiO2、Al2O3得到硅铝熔体,再加纯铝搅拌,得到硅铝合金,以此来解答.
解答 解:(1)铝土矿中的氧化铝和氧化铁能溶于强酸生成Al3+、Fe3+,另外还有剩余的H+,所以溶液中的金属阳离子有Al3+、Fe3+,
故答案为:Al3+、Fe3+;
(2)焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在300℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为300℃;气体Ⅰ为氨气,氨气可以用于制氮肥,也可以用硫酸吸收来备硫酸铵循环到焙烧过程中,
故答案为:300℃;制氮肥、用硫酸吸收气体(氨气)循环到焙烧过程中;
(3)由流程分析可知,操作①包括:加水溶解、过滤;溶液中含有铝离子与氢氧根离子生成偏铝酸根离子,其反应的离子方程式为Al3++4OH-=AlO2-+2H2O,
故答案为:过滤;Al3++4OH-=AlO2-+2H2O;
(4)在高温条件下,Al4C3与Al2O3反应生成Al和CO,其反应的方程式为Al4C3+Al2O3$\frac{\underline{\;高温\;}}{\;}$6Al+3CO↑或 3SiC+Al2O3=3Si+2Al+3CO↑,
故答案为:Al4C3+Al2O3$\frac{\underline{\;高温\;}}{\;}$6Al+3CO↑或 3SiC+Al2O3=3Si+2Al+3CO↑.
点评 本题考查了物质分离和提纯基本操作,为高频考点,把握流程中发生的化学反应为解答的关键,需要注意题干信息与所学知识的结合,侧重知识迁移应用能力的考查,本题的易错点是(4)中方程式的书写和配平,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2可用作制备光导纤维 | |
| B. | Na、K合金熔点比任何一个组分低 | |
| C. | 通过化学反应可实现12C到14C的转化 | |
| D. | 晶体硅可用于制作太阳能光板、制造芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ),莽草酸分子中有3个手性碳原子.
),莽草酸分子中有3个手性碳原子.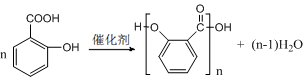 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中富集镁元素用NaOH沉淀法 | |
| B. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| C. | 从海水中提取溴单质的过程中用氯气做还原剂 | |
| D. | 将海带烧成灰,用水浸泡,乙醇萃取可以提取碘单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com