
【题目】I、通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答。
(1)用化学符号表示下列微粒:C:________,D:_________。
(2)写出A、B、E三种微粒反应的离子方程式:______________________。
II、A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物的化学式为AE,其分子中含18个电子。请回答下列问题:
(1)D元素的原子结构示意图为___________________。
(2)由A、B、C三种元素形成的化合物的电子式为_________________,这种化合物中所含的化学键类型有___________________。
(3)A2B的沸点高于A2D,其原因是______________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是_________________(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总化学反应方程式为___________________。
【答案】Ⅰ.(1)NH4+OH-;
(2)Al3++3NH3+3H2O=Al(OH)3↓+3 NH4+或Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+;
Ⅱ.(1)![]() ;(2)
;(2)![]() ;离子键、共价键;(3)H2O分子之间存在氢键;
;离子键、共价键;(3)H2O分子之间存在氢键;
(4)ClO-+H2O![]() HClO+OH-;2NaClO =2NaCl+O2↑;
HClO+OH-;2NaClO =2NaCl+O2↑;
【解析】试题分析:Ⅰ、(1)10电子微粒有:H2O、NH3、CH4、HF、NH4+、OH-、Al3+、Na+、O2-、F-等微粒,A、B、E三种微粒反应后可得C和一种白色沉淀,该白色沉淀为Al(OH)3或Mg(OH)2,应为Al3+或Mg2+和氨水溶液的反应,则C为NH4+,B溶于A,说明A为H2O,B为NH3,D应为OH-,故答案为:NH4+;OH-;
(2)氨水溶液呈碱性,Al3+或Mg2+和氨水溶液的反应生成Al(OH)3或Mg(OH)2,反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+,故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+;
Ⅱ.A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,故E为氯元素;A与C同主族,处于ⅠA族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,处于ⅥA族,B与D为同主族,原子序数B小于D,则B为氧元素,D为硫元素;C原子序数大于氧元素,C与氢元素为同主族,故C为钠元素。
(1)D为硫元素,原子结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)由A、B、C三种元素形成的化合物为NaOH,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为![]() .晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,故答案为:
.晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,故答案为:![]() ;离子键、共价键;
;离子键、共价键;
(3)H2O分子间存在氢键而H2S分子间不存在氢键,故H2O的沸点比H2S高,故答案为:H2O分子之间存在氢键;
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,该盐为NaClO,次氯酸钠属于强碱弱酸盐,在溶液中ClO-发生水解:ClO-+H2O![]() HClO+OH-,使溶液呈碱性,溶液pH>7;将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),HClO分解为HCl与氧气,HCl与氢氧化钠反应生成NaCl,故最终溶液几乎为NaCl溶液,溶液的pH近似为7,则该过程的总反应方程式为2NaClO=2NaCl+O2↑,故答案为:ClO-+H2O
HClO+OH-,使溶液呈碱性,溶液pH>7;将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),HClO分解为HCl与氧气,HCl与氢氧化钠反应生成NaCl,故最终溶液几乎为NaCl溶液,溶液的pH近似为7,则该过程的总反应方程式为2NaClO=2NaCl+O2↑,故答案为:ClO-+H2O![]() HClO+OH-;2NaClO=2NaCl+O2↑。
HClO+OH-;2NaClO=2NaCl+O2↑。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
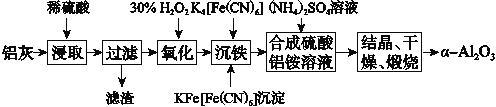
(1)铝灰中氧化铝与硫酸反应的化学方程式为__________________________。
(2)图中“滤渣”的主要成分为________(填化学式)。
(3)加30% H2O2溶液发生反应的离子方程式为_________________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为
4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnO被还原为Mn2+),发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位。回答下列问题:
(1)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中键角 120°(填“>”、“<”或“=”);SO3分子中S原子的杂化轨道类型为 ;V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 。
(2)VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,该反应用于钒含量的测定。写出反应的离子方程式 。
(3)钛在元素周期表中的位置为 ,其电子排布式为 。用乙醚从TiCl3的饱和溶液中萃取可得TiCl3·6H2O绿色晶体,其配位数为6,将1mol该晶体加入到足量硝酸银溶液中可得2mol白色沉淀,则该配合物的化学式是 。
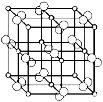
(4)科学家通过X射线探明,黄铁矿(FeS2)的晶体结构与NaCl的晶体结构相似,若在FeS2晶体中阴阳离子间最近距离为a cm,阿伏伽德罗常数为NA。则晶体密度表达式为 g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碱性氧化物一定是金属氧化物
B. 质子数、中子数和电子数都相同的粒子一定是同一种粒子
C. 任何元素在自然界中的存在形式都有化合态和游离态
D. 酸性氧化物一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
乙 醇 | -117.0 | 78.0 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥。
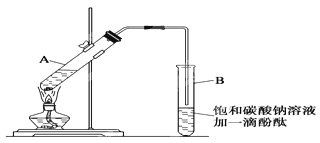
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:______,写出制取乙酸乙酯的化学方程式:______.
(2)上述实验中饱和碳酸钠溶液的作用是:______(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:______。
(4)指出步骤③所观察到的现象:______;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去______(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为______(填字母)。
A.P2O5B.无水Na2SO4C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图的装置相比,下图装置的主要优点有:____________、_________。(写出两条即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 离子键没有方向性和饱和性,而共价键有方向性和饱和性
B. 离子键的强弱主要决定于离子半径和离子所带电荷数
C. 配位键在形成时,由成键双方各提供一个电子形成一对共用电子
D. 金属键的实质是金属中的自由电子与金属阳离子形成的一种强烈的相互作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com