

| A. | 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O | |
| B. | 为了提高Ni的产率,电解过程中需要控制废水pH | |
| C. | 电解过程中,B中NaCl溶液的物质的量浓度将不断增大 | |
| D. | 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不会发生改变 |
分析 A.由图分析可知,碳棒与电源正极相连是电解池的阳极,阳极上氢氧根离子失电子生成氧气;
B.因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH;
C.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中;
D.若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电.
解答 解:A.由图分析可知,碳棒与电源正极相连是电解池的阳极,阳极上氢氧根离子失电子生成氧气,其电极反应4OH--4e-=2H2O+O2↑,故A正确;
B、因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),若pH较小,即氢离子浓度较大时,氢离子放电而Ni2+不放电,为了提高Ni的产率,电解过程中需要控制废水pH,故B正确;
C.镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,故C正确;
D.若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl---2e-=Cl2↑,电解反应总方程式会发生改变,故D错误;
故选D.
点评 本题考查了电解池原理的分析判断,主要是电解反应,电解产物判断,电解过程中溶液酸碱性的分析应用,掌握基础是关键,题目难度中等,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:多选题

| A. | b电极是负极 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 工作时溶液中阴离子移向正极 | |
| D. | 工作时正极区pH升高,负极区pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有的P-P键的个数为6NA | |
| B. | 12 g石墨中含有的C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有的C-C键的个数为4NA | |
| D. | 60 g SiO2中含Si-O键的个数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的苯酚(溴水) | B. | 乙醇中的水(新制的氧化钙) | ||
| C. | 苯酚中的乙酸(饱和碳酸钠溶液) | D. | 乙酸乙酯中的乙酸(乙醇) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片做阴极,石墨做阳极 | |
| B. | 白色沉淀在阴极附近生成 | |
| C. | 阳极区溶液变蓝的原因是:2Cu+4I--4e-═2CuI↓+I2,碘遇淀粉变蓝 | |
| D. | 阳极区溶液变蓝的原因是:4OH--4e-═2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
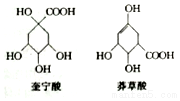 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| B. | 奎宁酸的相对分子质量比莽草酸的大16 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 1 mol该有机物完全燃烧可生成12molCO2 | |
| B. | lmol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等 | |
| C. | 1 mol该有机物可以与5mol H2发生加成反应 | |
| D. | 1 mol该有机物可以与2 molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 碱性:KOH<NaOH<Mg(OH)2 | D. | 还原性:Br->Cl->F- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com