
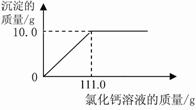
С��ͬѧΪ�˲ⶨ�������۵�ijƷ�ƴ������Ϊ�Ȼ��ƣ���̼���Ƶ���������������������ʵ�飺���������ձ��зֱ����11.0g��Ʒ��������ˮ�����Һ�����������ձ��зֱ����һ��������10.0%�Ȼ�����Һ���۽���ַ�Ӧ�����ɵij������ˡ�ϴ�ӡ�����������õ��İ�ɫ���塣��֪��Na2CO3 + CaCl2 = CaCO3��+ 2NaCl
ʵ���������ݼ��±�����������������йؼ��㣺
| �ձ�1 | �ձ�2 | �ձ�3 | |
| ����10.0%�Ȼ�����Һ��������g�� | 55.5 | 120.0 | 150.0 |
| ��ɫ�����������g�� | 5.0 | 10.0 | 10.0 |
��1����Ʒ��̼���Ƶ����������Ƕ��٣�(�����ȷ��0.1%)
 ��2������ͼ�л��Ƴ���ɫ����������Ȼ�����Һ��������ϵ����
��2������ͼ�л��Ƴ���ɫ����������Ȼ�����Һ��������ϵ����
ʵ�����ݿ�֪��11.0g��Ʒ�е�̼�������Ȼ�����Һ��ַ�Ӧ�������10.0g̼��ơ�
(1)�⣺��Ҫ����10.0g̼�����Ҫ̼���Ƶ�����ΪX
Na2CO3 + CaCl2 = CaCO3��+ 2NaCl ��1�֣�
106 100
X 10.0g ��1�֣�
106:100 = X��10.0g
���X=10.6g ��1�֣�
��Ʒ��̼���Ƶ����� ����Ϊ�� 10.6g/11.0g��100%=96.4% ��1�֣�
����Ϊ�� 10.6g/11.0g��100%=96.4% ��1�֣�
(2)��2�֣���������ϱ��ǡ�÷�Ӧʱ�Ȼ�����Һ��������������


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ�����ڱ���Ԫ�������ɵķ�����ͻ�����Ŀ�ѧ����
A�������� B�������ӵ��� C���Ž��з� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪[Co(NH3)6]3+����������ṹ��������������NH3���ӷֱ�H2Oȡ����
���γɵ�[Co(NH3)4(H2O)2]3+�ļ����칹�������У������ǹ�ѧ�칹�����֣� ��
A.2�� B.3�� C.4�� D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��A�IJ�����־��ʯ��ҵ��չ��ˮƽ�����뱽�ɷ����ӳɷ�Ӧ�������Ƕ����л�����л����ϺϳɵĻ���ԭ�ϡ���������кϳ�·�ߣ��ش����⡣��֪��C��D��ͬ���칹�壻M�ķ���ʽΪC8H6O3 ,�����ԣ��٢ڢ۷�Ӧ������ͬ��

(1)��A������Ϊ ��E�ķ���ʽΪ ��
(2)��Ӧ������������� ��J�Ľṹ��ʽΪ ��
(3)��Ӧ�۵ķ�Ӧ������ ��M�����Ĺ���������Ϊ ��
(4)��������������ΪH��ͬ���칹����л���Ľṹ��ʽΪ ��
a.���ڷ����廯���� b.����̼��������Һ��Ӧ��������
c.�����������ֲ�ͬ��������ԭ��
(5)д�����б仯�Ļ�ѧ����ʽ��
�� F��H��Ӧ����I ��
�� �߾���W��һ�������½��⣺ ��
 (6)��֪�� ��R��CN
(6)��֪�� ��R��CN 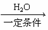 R��COOH
R��COOH
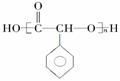
��д���� �Ʊ��߷��ӻ����� �ĺϳ�·������ͼ
ע��1.���Լ���ѡ�� 2.�ϳ�·������ͼʾ�����£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����°桶��������ˮ���������У�����ˮ����������Ŀǰ���õ�Һ���⣬������һ�Ȱ���NH2Cl����������O3���ȡ�
��1��O3����Ԫ�صĻ��ϼ��� ��
��2��NH2Cl�� �������֣���Ԫ����ɣ����е�Ԫ������Ԫ�ص��������� ��
��3����NH2Cl����ʱ��������ӦNH2Cl+X= NH3+HClO,����X�Ļ�ѧʽΪ ��.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ͼ��˵����ȷ����

A. ����ԭ���ʱCu�Ǹ���
B. ���ɵ���ʱCu������
C. ���ɵ���ʱ�������صļ�������
D. ��ع���ʱ��Һ�е� һ������Cu��
һ������Cu��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������л���Ľṹ�������йص�������ȷ����
A��������֬������ʹ����KMnO4��Һ��ɫ
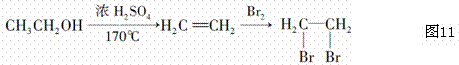
B�������Cl2�ķ�Ӧ����ϩ��Br2�ķ�Ӧ����ͬһ���͵ķ�Ӧ
C�������ǡ����ǵķ���ʽ��ΪC6H12O6������Ϊͬ���칹��
D���Ҵ������������Na��Ӧ�ų�H2�����߷����й�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�ܱ������м���A��B��C�������壬����һ���¶ȣ���t1��t4ʱ�̲�ø����ʵ�Ũ�����±����ݴ��ж����н�����ȷ����(����)
A����t3ʱ�̷�Ӧ�Ѿ�ֹͣ
B��A��ת���ʱ�B��ת���ʵ�
C����t2��t3��A��ƽ����Ӧ����Ϊ��[1/(t3��t2)]mol/(L��s)
D���������з����ķ�ӦΪ��2A��B  2C
2C
| �ⶨʱ��/s | t1 | t2 | t3 | t4 |
| c(A)/(mol/L) | 6 | 3 | 2 | 2 |
| c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com