
【题目】I.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_______________。
II.A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:
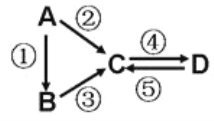
(3)若A是淡黄色单质固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式______________________________________。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是________________。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式________________________。
【答案】Al(OH)3+OH-=AlO2-+2H2O 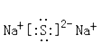 SO2+Na2O2=Na2SO4 第三周期ⅢA族 Cu+2Fe3+=Cu2++2Fe2+
SO2+Na2O2=Na2SO4 第三周期ⅢA族 Cu+2Fe3+=Cu2++2Fe2+
【解析】
I.(1)W、X都是金属元素,两者最高价氧化物对应的水化物可以反应生盐和水,说明一定是两性氢氧化物氢氧化铝和强碱的反应,则W是Na元素,X是Al元素;
(2)Na与Y 可形成化合物W2Y,则Y是S元素;
II.(3)若A是淡黄色固体,C、D是氧化物,由C是造成酸雨的主要物质可知,C为SO2,则A为S,C为SO2,B为H2S,D为SO3;
(4)由D物质具有两性,④反应是通入过量的一种引起温室效应的主要气体可知,D为Al(OH)3,C为NaAlO2,由②③反应均要用强碱溶液可知,单质A为Al,B为铝盐;
(5)由A是应用最广泛的金属可知,单质A为Fe,由④反应用到A,②⑤反应均用到同一种非金属单质可知,非金属单质为氯气,C为氯化铁,D为氯化亚铁。
(1)W、X都是金属元素,两者最高价氧化物对应的水化物可以反应生盐和水,说明一定是两性氢氧化物氢氧化铝和强碱的反应,则W是Na元素,X是Al元素,氢氧化钠溶液和氢氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)Na与Y 可形成化合物W2Y,则Y是S元素,Na2S是由钠离子和硫离子形成的离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)若A是淡黄色固体,C、D是氧化物,由C是造成酸雨的主要物质可知,C为SO2,则A为S,C为SO2,B为H2S,D为SO3,过氧化钠为淡黄色粉末,与二氧化硫反应生成硫酸钠,反应的化学方程式为SO2+Na2O2=Na2SO4,故答案为:SO2+Na2O2=Na2SO4;
(4)由D物质具有两性,④反应是通入过量的一种引起温室效应的主要气体可知,D为Al(OH)3,C为NaAlO2,由②③反应均要用强碱溶液可知,单质A为Al,B为铝盐,单质A为Al,铝元素位于元素周期表第三周期ⅢA族,故答案为:第三周期ⅢA族;
(5)由A是应用最广泛的金属可知,单质A为Fe,由④反应用到A,②⑤反应均用到同一种非金属单质可知,非金属单质为氯气,C为氯化铁,D为氯化亚铁,氯化铁溶液与铜反应生成氯化亚铁和氯化铜,常用于蚀刻印刷铜电路板,反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】I.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=127.4kJ/mol
②NaOH(s)+CO2(g) = NaHCO3(s) ΔH2=131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)的ΔH=____kJ/mol,不同温度下NaHCO3分解反应的平衡常数K313K____K298K(填“大于"“小于”或“等于”),该反应的平衡常数表达式K=______。
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() =____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
=____。(保留一位小数,已知Ksp(BaCO3)=2.6×109 ,Ksp(BaSO4)=1.1×1010)
II.Mg﹣H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,其工作原理如图所示,电池总反应是:Mg+H2O2+2H+═ Mg2++2H2O

(1)负极材料为_____,发生___反应(填“氧化”或“还原”)
(2)两极电极反应式为:
负极:_________________;正极:_________________;
(3)有4.8gMg反应时时,外电路中转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、R、W五种元素,其中X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z原子基态时2p原子轨道上有3个未成对的电子,R单质占空气体积的![]() ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:
(1)Y2X4分子中Y原子轨道的杂化类型为________,1mol Z2X4含有σ键的数目为 ________。
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为 ________,两种化合物分子中化学键的键角较小的是________(用分子式表示,下同)。
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序________,理由是 ________;三者的沸点由高到低的顺序是 ________,解释原因________。
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是________。
(5)W元素有________个运动状态不同的电子,其基态原子的价电子排布式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式_____________。
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用图中的曲线表示是________(填序号).

(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 古人煮沸海水制取淡水,现代可通过向海水加入明矾实现海水淡化
B. 我国山水画所用的炭黑与“嫦娥四号”卫星所使用的碳纤维互为同分异构体
C. 某些筒装水使用的劣质塑料桶常含有乙二醇(![]() ),乙二醇不溶于水
),乙二醇不溶于水
D. “一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称,真丝绸的主要成分是蛋白质,属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的____(填字母代号)。
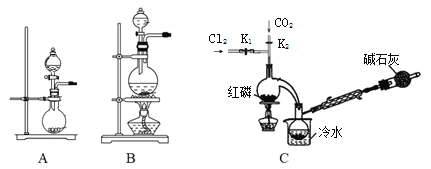
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是______________。
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
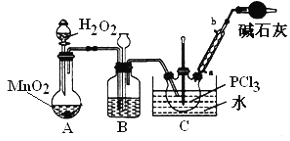
资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为___________________________________。
(4)反应温度要控制在60~65℃,原因是:_________________________________。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 molL﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 molL﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是__________________________________________。
②产品中Cl元素的质量分数为______________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是( )
A. 标况下,22.4L C2H2 中所含的 π 键数和 18g 冰中所含的氢键数均为 2NA
B. 双原子或多原子形成的气体单质中,一定有 σ 键,可能有 π 键
C. NH4+与 H3O + 均为 10 电子粒子,它们互为等电子体
D. 一个 P4S3 分子(结构如图)中含有三个非极性共价键

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com