
【题目】完成下列填空:
(1)写出氯化钠的电子式_______________,氮气的结构式______________;
(2)用离子方程式表示氨水溶液显碱性的原因_________________;
用离子方程式表示碳酸钠溶液显碱性的原因_____________________;
(3)某碳氢化合物的相对分子质量为72,且一个分子结构中有3个甲基,则该有机物的结构简式为____________,该有机物的系统命名是_____________。
【答案】 ![]() N≡N NH3·H2O
N≡N NH3·H2O![]() NH4++OH- CO32-+H2O
NH4++OH- CO32-+H2O![]() HCO3-+OH- (CH3)2CHCH2CH3 2—甲基丁烷
HCO3-+OH- (CH3)2CHCH2CH3 2—甲基丁烷
【解析】(1)本题考查电子式的书写和结构式的书写,NaCl属于离子化合物,即电子式为:![]() ,氮气中两个氮原子之间以叁键的形式结合,结构式为:N≡N;(2)本题考查弱电解质的电离和盐类水解方程式的书写,NH3·H2O是弱碱,电离是部分电离,即电离方程式为:NH3·H2O
,氮气中两个氮原子之间以叁键的形式结合,结构式为:N≡N;(2)本题考查弱电解质的电离和盐类水解方程式的书写,NH3·H2O是弱碱,电离是部分电离,即电离方程式为:NH3·H2O![]() NH4++OH-,使的溶液中c(OH-)>c(H+),溶液显碱性;碳酸钠属于强碱弱酸盐,CO32-水解造成溶液显碱性,即CO32-+H2O
NH4++OH-,使的溶液中c(OH-)>c(H+),溶液显碱性;碳酸钠属于强碱弱酸盐,CO32-水解造成溶液显碱性,即CO32-+H2O![]() HCO3-+OH- ;(3)本题考查有机物分子式的确定和有机物的命名,72÷ 12= 5…12,商为碳原子数,余数为氢原子,即此有机物的分子式为C5H12,属于烷烃,此有机物中含有三个甲基,即结构简式为(CH3)2CHCH2CH3,名称为2-甲基丁烷。
HCO3-+OH- ;(3)本题考查有机物分子式的确定和有机物的命名,72÷ 12= 5…12,商为碳原子数,余数为氢原子,即此有机物的分子式为C5H12,属于烷烃,此有机物中含有三个甲基,即结构简式为(CH3)2CHCH2CH3,名称为2-甲基丁烷。


科目:高中化学 来源: 题型:
【题目】最近医学界通过用具有放射性的14C实验,发现C80的一种羧酸的衍生物在特定条件下可通过断裂DNA杀死病毒,从而抑制艾滋病(AIDS)的传播。有关14C的叙述中正确的是( )
A. 与C80中普通碳原子的化学性质不同B. 与12C互为同位素
C. 与12C的中子数相同D. 与C80互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积为0.5L的密闭容器中发生如下反应。mA(g)+nB(g)![]() pC(g)+qD(s) △H<0(m、n、p、q为最简整数比)。 A、B、C、D的物质的量变化如图所示。
pC(g)+qD(s) △H<0(m、n、p、q为最简整数比)。 A、B、C、D的物质的量变化如图所示。

(1)前3 min,v(C)=_____________。
(2)当下列物理量不再发生变化时,表明该反应已达到平衡状态的是________(填选项字母)。
A.混合气体的压强 B.混合气体的密度
C.混合气体的平均相对分子质暈
D.B的物质的量 E.混合气体的总物质的量
(3)T℃时,该反应的平衡常数K=____________。(小数点后保留2位)
(4)反应达到平衡后,下列措施对A的转化率无影响的是___________(填选项字母)。
A.保持体积不变,再通入2molA和1molB
B.移走一部分D C.把容器的体积缩小一倍 D.升高温度
(5)T℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 molD, 此时v(正)________ (逆)(填“>”、“<”或“=”),判断的依据是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:

已知:在质谱图中烃A的最大质荷比为118,其苯环上的一氯代物共三种,核磁共振氢谱显
示峰面积比为3:2:2:2:1。
根据以上信息回答下列问题:
(1)A的官能团名称为__________________,B→C的反应条件为_____________,E→F的反应类型为_____________。
(2)I的结构简式为____________________,若K分子中含有三个六元环状结构,则其分子式为________________。
(3)D与新制氢氧化铜悬浊液反应的离子方程式为_______________________________。
(4)H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式___________________________________。
(5)J是一种高分子化合物,则由C生成J的化学方程式为
______________________________________________________________________。
(6)![]() 已知:
已知:![]() (R为烃基)
(R为烃基)
设计以苯和乙烯为起始原料制备H的合成路线(无机试剂任选)。
[合成路线示例:]![]()
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(夹持装置已省略):

己知:①SO2(g)+Cl2(g)![]() SO2Cl2(I) ΔH=-97kJ/mol;
SO2Cl2(I) ΔH=-97kJ/mol;
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气
回答下列问题:
(1)装置H的名称是_______________,装置E中活性炭的作用是 _____________。
(2)请指出下列装置中应盛入的试剂:B_____________、F________________。
(3)若采用实验室制法制取Cl2,其发生装置应选择_________装置 (用A、B、C等编号填空〉,其中发生反应的离子方程式为____________________。
(4)为什么硫酰氯在潮湿空气中易“发烟”____________ (结合化学方程式说明)。
(5)为了使通入反应器的SO2和Cl2达到最佳反应比例,可观察_________(填现象)来反映通入气体的速率,利用反应液的滴加快慢对气体通入速率加以控制。
(6)该装置尚存在明显的缺陷,请指出_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1, 4-二苯基丁烷。(格拉泽反应:2R-C≡C-H![]() R-C≡C-C≡C-R+H2)
R-C≡C-C≡C-R+H2)

回答下列问题:
(1)②和⑤的反应类型分别为__________________、____________。
(2)反应③由C生成D的条件是_____________________。
(3)E的结构简式为___________,该分子中位于同一直线上的原子最多是___________个。
(4)反应①的化学方程式是___________。
(5)C与足量氢氧化钠水溶液反应可制得化合物F,F的分子式是__________,同时符合下列条件的F的同分异构体有_____________种(不含立体异构)。
①1mol该异构体最多能与2mol NaOH溶液反应
②该异构体的核磁共振氢谱显示为3组峰,且峰面枳之比为1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 的表述不正确的是( )
的表述不正确的是( )
A. 该物质能发生缩聚反应
B. 该物质有7种不同化学环境的氢原子
C. 该物质遇FeCl3溶液显色,1 mol该物质最多能与含1 mol Br2的溴水发生取代反应
D. 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜(只允许阳离子通过)、阴离子交换膜(只允许阴离子通过)、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。下列说法正确的是

A. 阳极反应式为2H++2e-===H2↑
B. 从D口出来的是NaOH溶液
C. 阴极区pH降低
D. 当电路中通过2mol电子的电量时,会有1mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带在盐酸中反成,产生H2的速率(v)与时间(t)的关系如下图所示。
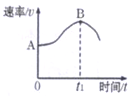
(1)写出该反应的离子方程式____________________。
(2)下列变化:①H+的浓度②镁带的表面积③溶液的温度④Cl-的浓度,不能影响该反应速率的有_________(填写选项的序号)。
(3)0~t1,时间段速率逐渐加快的主要原因是___________。
(4)t1时刻后反应速率变慢的主要原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com