
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z<M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
分析 X、Y、Z、M四种短周期元素,Z、M位于同主族,Z的核电荷数是M的2倍,可推知Z为S元素、M为O元素;Y、Z位于同周期,处于第三周期,X与Z、M都不在同一周期,则X处于第一周期,可推知X为H元素,X、Y位于同主族,则Y为Na,据此解答.
解答 解:X、Y、Z、M四种短周期元素,Z、M位于同主族,Z的核电荷数是M的2倍,可推知Z为S元素、M为O元素;Y、Z位于同周期,处于第三周期,X与Z、M都不在同一周期,则X处于第一周期,可推知X为H元素,X、Y位于同主族,则Y为Na,
A.X为H元素,Y为Na,元素的金属性越强,其简单阳离子的氧化性越弱,金属性Na强,所以阳离子氧化性:Na+<H+,故A错误;
B.Z为S元素、M为O元素,非金属性O>S,故氢化物稳定性H2O>H2S,故B正确;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Na+,故C正确;
D.H2S溶液中硫化氢电离,溶液呈酸性,抑制水的电离,而Na2S的溶液中,硫离子水解,促进水的电离,故Na2S溶液中水的电离程度更大,故D正确,
故选A.
点评 本题考查结构性质位置关系应用,“Z、M位于同主族,Z的核电荷数是M的2倍”是推断突破口,是对基础知识的综合考查,难度不大,注意元素周期律的灵活运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3•H2O)=1×10-4mol•L-1 | |
| B. | 由CH3COOH与CH3COONa组成的pH=5.6的混合溶液中:c(Na+)<c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
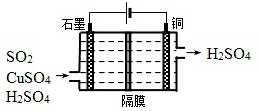
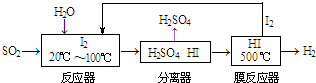
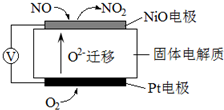
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
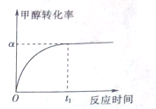 乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:
乙酸是重要的有机化工原料,可由乙烯氧化法、甲醛羟基化法等方法生产.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
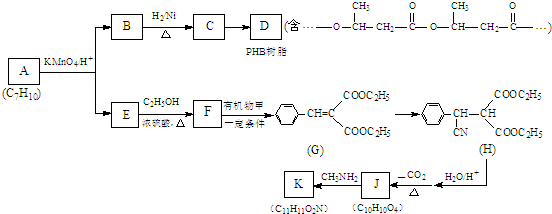
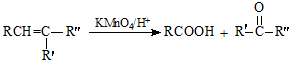
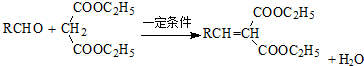
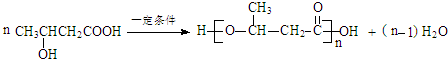 .
. .
.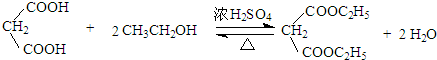 .
.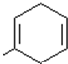 .
.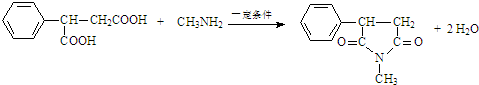 .
.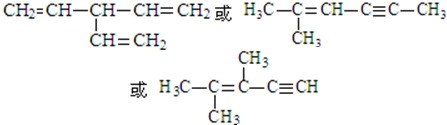 (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中逐滴加入少量稀盐酸:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 稀Fe(NO3)2溶液中加入稀盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2稀溶液:NH4++Al3++2SO42-+2Ba2++5OH-═2BaSO4↓+NH3•H2O+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
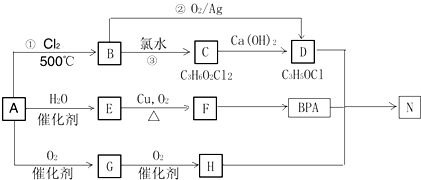
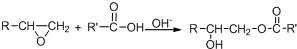
 .
.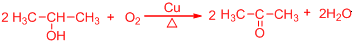 .
.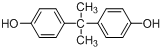 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
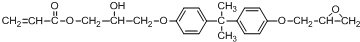
.
 (其中两种).
(其中两种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:简答题
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H2=bkJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ·mol-1
则C的燃烧热________kJ·mol-1
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:

①反应达平衡的标志是(填字母代号)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为。
③若提高N2的转化率可采取的措施有。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大E.加入一定量的N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com