
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:

| ||
| ||

| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题. CH3COOC2H5+H2O
CH3COOC2H5+H2O CH3COOC2H5+H2O
CH3COOC2H5+H2O 状液体产生.若分离B中的液体混合物需要用到的主要玻璃仪器是
状液体产生.若分离B中的液体混合物需要用到的主要玻璃仪器是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
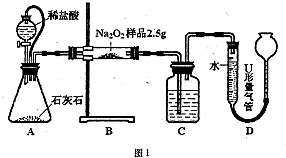
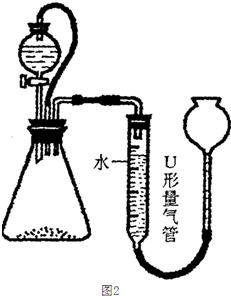
(0.2×0.03×
| ||||
| 2.5g |
(0.2×0.03×
| ||||
| 2.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
| ③ | 淀粉-KI试纸变蓝色 | 氯水中含有Cl2 | |
| ④ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中含有H+ |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖南省长沙市高三第六次月考化学试卷 题型:填空题
某班级同学查阅资料,对Na2S有了一定的认识,并提出了以下几个问题,请回答:
(1)1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
向容器中分别加入以下物质,判断对平衡有无影响,有影响的填写出平衡移动的方向。
①加入Na2SO4 。②加入焦炭 。
(2)向Na2S的浓溶液中逐滴加入稀盐酸,直到不再生成H2S气体为止,则在此过程中,溶液的c(HS-)变化趋势可能是 。
a.逐渐减小 b.逐渐增大
c.先逐渐增大,而后减小 d.先逐渐减小,而后增大
(3)Na2S溶液与下列溶液混合,不能发生反应的是 。
①H2S ②SO2 ③Na2SO3 ④酸性KMnO4溶液 ⑤CuSO4 ⑥氯水
(4)写出Na2S和AlCl3溶液反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com