
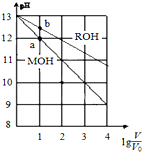
 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | MOH的物质的量浓度大于ROH | |
| B. | 水的电离程度:b点大于a点 | |
| C. | 两溶液在稀释过程中,溶液中各离子浓度都减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减少 |
分析 由图可知pH=13的MOH溶液稀释10倍,溶液的pH=12,说明MOH完全电离,所以MOH为强碱,所以ROH是弱碱,
A、pH相同时弱碱的浓度大于强碱;
B、碱性越强对水的电离的抑制程度越大;
C、两溶液在稀释过程中,溶液中显性离子的浓度减小,隐性离子的浓度增大;
D、升高温度促进弱碱的电离,金属阳离子浓度增大,强碱的金属阳离子浓度不变.
解答 解:由图可知pH=13的MOH溶液稀释10倍,溶液的pH=12,说明MOH完全电离,所以MOH为强碱,所以ROH是弱碱,
A、pH相同时弱碱的浓度大于强碱,所以MOH的物质的量浓度小于ROH,故A错误;
B、碱性越强对水的电离的抑制程度越大,b点碱性大于a点的碱性,所以水的电离程度:b点小于a点,故B错误;
C、两溶液在稀释过程中,溶液中显性离子氢氧根离子的浓度减小,隐性离子氢离子的浓度增大,故C错误;
D、升高温度促进弱碱的电离,金属阳离子浓度增大,强碱的金属阳离子浓度不变,所以M+的浓度不变,因此$\frac{c({M}^{+})}{c({R}^{+})}$减少,故D正确;
故选D.
点评 本题考查弱电解质电离与影响因素、电离平衡常数、pH有关计算等,关键是根据pH的变化判断强弱电解质,注意理解电离平衡常数计算过程中的估算问题,题目难度中等.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.032mol•L-1 | B. | 0.036mol•L-1 | C. | 0.04mol•L-1 | D. | 0.045mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中Fe和Cu的物质的量之比为3:2 | |
| B. | 消耗NaOH溶液体积为260mL | |
| C. | 所得沉淀的质量m=9.83g | |
| D. | 混合物消耗HNO3的物质的量为0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
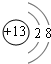 ,非金属性最强的是F.
,非金属性最强的是F.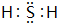 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸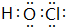 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com