
����Ŀ����������(NaN3)��һ����ɫ���壬�㷺����������ȫ���Ҽ������ϳɵȣ������������Ʊ�����Ϊ��
2NaNH2+N2O�TNaN3+NaOH+NH3��
3NaNH2+NaNO3�TNaN3+3NaOH+NH3��
(1)�ٵ�ԭ�ӵ�L������Ų�ͼ_____________________��
�ڵ����ڵ������У���һ����������Ԫ��Ϊ_____________����Ԫ�ط��ţ���
����N3��Ϊ�ȵ����������Ϊ____________��д��һ�֣���
�ܰ����ĵ���ʽ____________��
(2)NH3�е㣨��33.34�棩��N2O�е㣨��88.49�棩�ߣ�����Ҫԭ����____________
(3)���ݼ۲���ӶԻ������ۣ�NO3-�乹�ͳ�__________����
(4)������ȫ���ҵ�����ǻ��ڷ�Ӧ6NaN3+Fe2O3�T3Na2O+2Fe+9N2�����������е�����һ�ֳ������ʣ������ľ��������ֶѻ���ʽ���������ֵĶѻ���ʽ��ͼ��ʾ�������й����������˵������ȷ����_________��
A���������ĵ�����������ͨ��ʱ���������ɵ����������ƶ�
B������Fe���é�Fe�Ķѻ���ʽ�ֱ���غ�ͭ��ͬ
C���ռ�����������Fe�����é�Fe
D���������ڲ����ڽ�����
(5)�����������־��壨����Fe���é�Fe�����ܶȱ�ֵΪ___________����д��С��������2λ��Ч���֣�

���𰸡�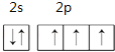 Ne CO2��
Ne CO2��  �������Ӽ������� ƽ������ BD 0.92
�������Ӽ������� ƽ������ BD 0.92
��������
(1)�ٵ���7��Ԫ�أ�ԭ�Ӻ��������Ϊ7����������Ų���2��5��ԭ�ӵ�L������5��������2s�ܼ�����2�����ӡ�2p�ܼ�����3�����ӣ������������ԭ�������ع����ﲻ����ԭ��֪����L������Ų�ͼΪ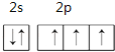 ��
��
��N�ǵڶ����ڵ�Ԫ�أ���ͬһ�����У�Ԫ�ص�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�ش�������Ԫ�أ����Եڶ�����Ԫ���е�һ�����������Ƕ�������Ԫ��Ne��
�ۼ۵�������ȡ�ԭ�Ӹ�����ȵ�������ȵ����壬����N3��Ϊ�ȵ������������CO2��N2O�ȣ�
�ܰ��������е�ԭ�Ӻ�ÿ����ԭ��֮�䶼����һ�����õ��Ӷԣ���ԭ���ϻ���һ�Թ¶Ե��ӣ����������ӵĵ���ʽΪ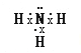 ��
��
(2)NH3�д��������N2O�в��������������֮������Ĵ��ڣ������˷���֮�����������ʹ�����ۻ���������Ҫ�ϸߵ�����������NH3�е㣨-33.34�棩��N2O�е㣨-88.49�棩�ߣ�
(3)NO3-�м۲���ӶԸ���=3+(5+1-3��2)/2=3�Ҳ����µ��Ӷԣ�������ռ乹��Ϊƽ�������Σ�
(4)A���������ĵ�����������ͨ��ʱ���ɵ����������ƶ������Ӳ���ͨ��Ų����ģ���ѡ��A����
B����-Fe����-Fe�Ķѻ���ʽ�ֱ���غ�ͭ��ͬ����-FeΪ���������ѻ�����-FeΪ���������ѻ�����ѡ��B��ȷ��
C������Fe�����־����Ϸ�ʽ��֪���ռ������ʦ�-FeС�ڦ�-Fe����ѡ��C����
D�����������д��ڽ����������Խ������ڲ����ڽ���������ѡ��D��ȷ��
��˺���ѡ����BD��
(5)��-Fe��Feԭ�Ӹ���=![]() =2����-Fe��Feԭ�Ӹ���=
=2����-Fe��Feԭ�Ӹ���=![]() =4����Feԭ�Ӱ뾶Ϊr����-Fe�о����߳�=
=4����Feԭ�Ӱ뾶Ϊr����-Fe�о����߳�=![]() ����-Fe�о����ı߳�=
����-Fe�о����ı߳�=![]() �������ܶȹ�ʽ�ɵ���-Fe���ܶ�
�������ܶȹ�ʽ�ɵ���-Fe���ܶ�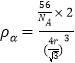 ����-Fe���ܶ�Ϊ
����-Fe���ܶ�Ϊ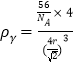 ���������ܶ�֮��Ϊ
���������ܶ�֮��Ϊ![]() =
=![]() ��
��![]() =0.92
=0.92


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ���е����ʾ�������Ի�������ʽ���ڣ�Ϊ�˱����о������ã�����Ի������з�����ᴿ������A��B��C��D����ѧ�����Ļ���������ᴿ��װ�á�

I������ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D�����ʵ��Ŀո��С�
��1��̼�������Һ�з����̼���_____��
��2���Ȼ�����Һ�з�����Ȼ���____��
��3������ֲ���ͺ�ˮ____��
��4����ˮ����___��
��5����ȥ����ˮ�е�Cl��������____��
��6���ӵ�ˮ�з����I2____��
II����ˮ����ȡ�ⵥ�ʵķ������£�
��1����ȡ��Һ
�����п���Ϊ��ˮ����ȡ�ⵥ����ȡ������____
A���ƾ� B����
�ڷ�Һ©����ʹ��ǰ������____
�۲����ϵ�֪������H2O��>��������>�����ƾ��������â�����ѡ��ȡ����ȡ��ˮ�еĵⵥ�ʣ���Һʱ���ϲ�Һ����___ɫ��
��2������
��װ��A��a��������___��a�м�������___��ֹ����ʱҺ�屩�С�����װ��������ˮӦ��____�ڽ�����������������������
����֪������Ȼ�̼���۷е��������
�۵� | �е� | |
�� | 113.7�� | 184.3�� |
���Ȼ�̼ | -22.6�� | 76.8�� |
���������������Ȼ�̼�Ļ�����ƿ�����ռ��������ʵ�������______��
��ˮ���̲��ŷḻ����Դ����ʵ������ȡ������ˮ�������������̵�ʵ�飺
[��ˮ]![]() [����]
[����]![]() [ʳ��ˮ]��[�Ȼ��ƾ���]
[ʳ��ˮ]��[�Ȼ��ƾ���]
����һ�������к�Ca2+��Mg2+��SO42�������ʣ���Ҫ�ᴿ������ۺ����á������ᴿ�IJ����У�
�ټ��������Na2CO3��Һ �ڼ��������BaCl2��Һ �ۼ��������NaOH��Һ �ܵ�����Һ��pH����7 ���ܽ� ���� ����������ȷ�IJ���˳����____����ѡ����ĸ��
a���ݢڢۢ٢ޢܢ� b���ݢ٢ڢۢޢܢ�
c���ݢڢ٢ۢܢޢ� d���ݢۢڢ٢ޢܢ�
��������������е�____ʱ��ֹͣ���ȡ�
�������������к���������ɳ��CaCl2��MgCl2�������Σ��������ܽ���ȹ��˽���ɳ��ȥ���ټ�����Һ�е�SO42������μ���ijδ֪��Һ�е�SO42��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LED(Light Emitting Diode)����������ܣ���һ���ܹ�������ת��Ϊ���ܵĹ�̬�뵼����������ͼ��ij����С����Ƶ��û�ѧ��Դʹ LED �Ʒ����װ�á�����˵������ȷ���ǣ� ��
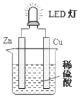
A.װ���д��ڡ���ѧ�ܡ����ܡ����ܡ���ת��
B.��Һ�� SO42-���ƶ�
C.ͭΪ������пΪ����
D.�����пƬ������Ƭ�����·�еĵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A0.2mol����������ȫȼ�պ�����![]() ��
��![]() ��1.2mol���ش��������⣺
��1.2mol���ش��������⣺
(1)��A�ķ���ʽΪ______��
(2)����A����ʹ��ˮ��ɫ������һ������������������ȡ����Ӧ��������ȡ����ֻ��һ�֣�����A�Ľṹ��ʽΪ______��
(3)��ȡһ�����ĸ���A��ȫȼ�պ�����![]() ��
��![]() ��3mol������______g��A�μ��˷�Ӧ��ȼ��ʱ���ı�״���µ�����______L��
��3mol������______g��A�μ��˷�Ӧ��ȼ��ʱ���ı�״���µ�����______L��
(4)����A��ʹ��ˮ��ɫ���ڴ��������£���![]() �ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4����������A���ܵĻ�����ʽ��(�����������칹)______��
�ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4����������A���ܵĻ�����ʽ��(�����������칹)______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʡ�����˵����ȷ����(����)

A. ��ͼ����MnO2��������Ũ�����ȫ��������
B. ��ͼ��֤��������ˮ�������Ժ�Ư����
C. ��ͼ���������ػ�ɫ����
D. ��ͼ����ɫ��������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2�ȴ�����Ⱦ����Ĵ�������������Ҫ���塣һ���¶��£�NO2������SO2�����������·�Ӧ��NO2(g)+SO2(g)![]() NO(g)+SO3(g)+Q�����������գ�
NO(g)+SO3(g)+Q�����������գ�
��1��д���÷�Ӧƽ�ⳣ������ʽK=___________________________��
��2�����ܼӿ췴Ӧ�ٶ�����ʹƽ��������Ӧ�����ƶ���������_______________������ţ���
a. ��ѹ b. �Ƴ�SO3 c. ͨ��NO2 d. �Ӵ���
��3����㶨������ܱ������зֱ����1molNO2��1molSO2����ò�ͬ�¶ȡ���Ӧ��ͬʱ��ʱ��NO2��ת������ͼ��ʾ���жϣ�
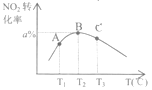
�ٷ�Ӧ��Q_____0���<����>������
��A��B��C����ıȽϣ���ȷ����________������ţ���
a. �������ʵ�����n(A)>n(B)
b. ���ʣ�v(B)>v(C)
c. SO3���������B>C
��4���п�Ժ�о��Ŷ�ͨ��ģ��ʵ��������ٴ����������������϶�ˮʱ��NO2��������SO2��������һ�ֶ�Ԫǿ�ᣬд����ǿ��ĵ��뷽��ʽ_______________________________��
�ڴ���ʩ�õ��ʣ������ӿ����е�NH3Ũ�ȣ�NH3�ɽ�������Ԫǿ��ת��Ϊ��Ӧ�Σ�PM2.5����Ҫ�ɷ�֮һ����д���÷�Ӧ�Ļ�ѧ����ʽ_______________________________��
��5����Na2CO3��Һ����SO2���ų���ζ���岢����һ�����Σ�д���÷�Ӧ�����ӷ���ʽ_________________������������Һ�к�S������Ũ���ɴ�С����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.�����������ʣ���NaCl���壻��Һ̬CO2����Һ̬�Ȼ��⣻�ܹ����ݹ���BaSO4�������ǣ��߾ƾ��������ڵ�Na2CO3����ش��������⣺
��1�������������ܵ������____��
��2�������������ڵ���ʵ���____��
��3�������������ڷǵ���ʵ���____��
��4��������������ˮ���γɵ���Һ�ܵ������_____��
��5���������____��
��6��д��������ˮ�еĵ��뷽��ʽ____��
��.��һ�������£����������ʣ���8gCH4��6.02��1023��HCl���Ӣ�2molO2������С�����˳����д���пհ�(��д���)��
��1��Ħ������____����2�����ʵ���_____��
��3��������Ŀ_____����4��ԭ����Ŀ____��
��5������_____��
III.��1�����뽺�����Һ���õķ�����____��
��2����������O2��O3����ԭ�Ӹ�����Ϊ____��
��3����agij�����к��еķ�����Ϊb����cg�������ڱ�״���µ������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2һ����������������(K)�dz���ҽҩ�м��壬����G�dz����߷��Ӳ��ϣ����ǵĺϳ�·������ͼ��ʾ��

��֪������̬����A�ڱ�״���µ��ܶ�Ϊ1.875g��L-1��

��1��B������Ϊ__________��E�Ľṹ��ʽΪ__________��
��2�������й�K��˵����ȷ����__________��
A.������ˮ��������CCl4
B.��������Ԫ����̼ԭ�Ӿ�����ͬһƽ��
C.�ܷ���ˮ�ⷴӦ�ӳɷ�Ӧ
D.1molK��ȫȼ������9.5molO2
��3���ķ�Ӧ����Ϊ__________���ߵĻ�ѧ����ʽΪ__________
��4����F�����ŵ��������Ŀ��ȫ��ͬ��ͬ���칹����__________��(��������ṹ)�����к˴Ź�������Ϊ4��壬�ҷ����֮��Ϊ1��2��3��4����__________(д�ṹ��ʽ)��
��5���������Ϻϳ�·���е������Ϣ����д�����Ҵ�Ϊԭ��(�������Լ���ѡ)�Ʊ�![]()
�ĺϳ�·�ߣ�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�������ж���ȷ����

A. ���ţ���֬-����KCl��Һ���е�K������b�ձ���Һ��
B. �ձ�b�з����ĵ缫��ӦΪZn��2e- ��Zn2+
C. �ձ�a�з�����ӦO2+4H+ +4e- ��2H2O����ҺpH����
D. ���ձ�a�м�������K3[Fe(CN)6]��Һ������ɫ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com