
分析 (1)氯化铁是强酸弱碱盐,铁离子水解导致其溶液呈酸性;
(2)氯化铵电离生成铵根离子,导致溶液中铵根离子浓度增大,抑制一水合氨电离;
(3)①某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,水溶液中都存在某溶液中只存在OH-、H+,如果溶液中溶质是一种,只能是醋酸钠;
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),溶液呈碱性,且c(OH-)>c(CH3COO-),说明溶液碱性很强,溶质为NaOH和醋酸钠;
③若溶液中c(Na+)=c(CH3COO-),根据电荷守恒得c(OH-)=c(H+),醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸的物质的量应该稍微大些.
解答 解:(1)氯化铁是强酸弱碱盐,铁离子水解导致其溶液呈酸性,溶液的pH<7,水解方程式为FeCl3+3H2O?Fe(OH)3+3HCl,故答案为:<;FeCl3+3H2O?Fe(OH)3+3HCl;
(2)氯化铵电离生成铵根离子,导致溶液中铵根离子浓度增大,抑制一水合氨电离,导致溶液中氢氧根离子浓度减小,pH减小,故答案为:溶液中铵根离子浓度增大抑制一水合氨电离;
(3)①某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,水溶液中都存在某溶液中只存在OH-、H+,如果溶液中溶质是一种,只能是CH3COONa,醋酸根离子水解导致溶液呈碱性,但水解程度较小,离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),溶液呈碱性,且c(OH-)>c(CH3COO-),说明溶液碱性很强,溶质为NaOH和CH3COONa,故答案为:NaOH和CH3COONa;
③若溶液中c(Na+)=c(CH3COO-),根据电荷守恒得c(OH-)=c(H+),醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸的物质的量应该稍微大些,因为二者体积相等,所以混合前c(NaOH)<c(CH3COOH),
故答案为:<.
点评 本题考查离子浓度大小比较、盐类水解、弱电解质的电离等知识点,侧重考查基本原理,溶液体积酸碱性、离子浓度大小比较、电解质类型进行分析解答,难点是(3)题③的解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维素和油脂都属于天然高分子化合物 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 铁是人体必须的微量元素,所以要多吃含Fe3+的食物 | |
| D. | 生活中常见的酚醛树脂由苯酚和乙醛通过聚合反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
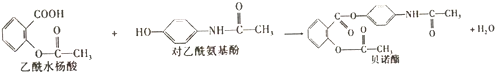
| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
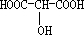 ;
;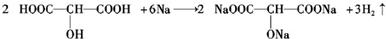 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | C5H12O | C6H14O | … |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L氯气通入足量水中反应,转移的电子数为NA | |
| B. | 乙烯和氮气组成的28g混合气体中含有NA个分子 | |
| C. | 1molNa2O2中阳离子和阴离子数均为2NA | |
| D. | 1molFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. CH3COOC2H5+H2O,该反应类型是酯化(取代)反应.
CH3COOC2H5+H2O,该反应类型是酯化(取代)反应. 2CH3CHO+2H2O.
2CH3CHO+2H2O.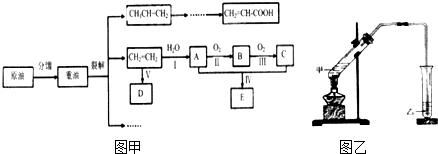
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com