
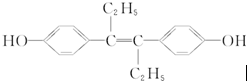
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3溶液发生反应 | |
| C. | 该有机物分子中一定有14个碳原子共平面 | |
| D. | 1 mol该有机物可与5 mol Br2发生反应 |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.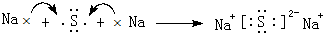 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2═HCOONa+H2O.储氢、释氢过程均无能量变化 | |
| B. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的热效应相同 | |
| C. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 | |
| D. | 过程N2(g)-→2N(g)放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水用Fe作为催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下得到纯净的CH3Cl | |
| D. | 乙烯通入溶有Br2的CCl4溶液可得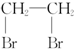 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用,制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用现代分析仪器测定TiO2粒子的大小.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③⑤ | C. | ③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-x-2}{W-m}$ mol | B. | $\frac{W(m-x)}{m}$ mol | C. | $\frac{W(m-x-2)}{m}$mol | D. | $\frac{W(m-x+2)}{m}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com