
��1���ڷ�Ӧ2SO2��O2 2SO3�У���a mol SO2��b mol O2�μӷ�Ӧ���ﵽ��ѧƽ��״̬ʱ��c mol SO3���ɣ���SO2��ƽ�������е��������Ϊ������ ��
2SO3�У���a mol SO2��b mol O2�μӷ�Ӧ���ﵽ��ѧƽ��״̬ʱ��c mol SO3���ɣ���SO2��ƽ�������е��������Ϊ������ ��
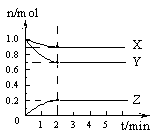
��2��ij�¶�ʱ����5 L�������У�X��Y��Z������������ʵ�����ʱ��ı仯��������ͼ��ʾ��
�ٷ�Ӧ��ʼ��2 mim�� Z��ƽ����Ӧ����Ϊ�������� ��
�ڷ����й����ݣ�д��X��Y��Z�ķ�Ӧ����ʽ������ ��
�۽�a molX��b molY�Ļ�����巢��������Ӧ����Ӧ��ijʱ�̸����ʵ���ǡ�����㣺n(X)=n(Y)=n(Z),��ԭ���������a��b=������ ��
 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
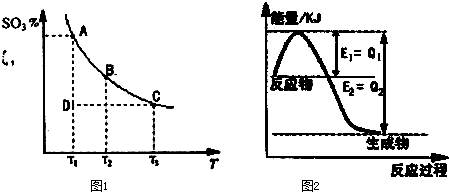
 2SO3��g�� ��ÿ�ʼʱ��SO2��O2����SO3��Ũ�ȷֱ�Ϊ0.2mol?L-1��0.1mol?L-1��0.2mol?L-1���ڷ�Ӧ�����в��ϲ�������и����ʵ�Ũ�ȣ����вⶨ���ݿ϶�����ȷ���ǣ�������
2SO3��g�� ��ÿ�ʼʱ��SO2��O2����SO3��Ũ�ȷֱ�Ϊ0.2mol?L-1��0.1mol?L-1��0.2mol?L-1���ڷ�Ӧ�����в��ϲ�������и����ʵ�Ũ�ȣ����вⶨ���ݿ϶�����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡТ�и���ѧ��һ��ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
�Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�
2SO2��g��+O2��g�� 2SO3��g��
2SO3��g��
��1�����ڷ�Ӧ2SO2��g��+O2��g�� 2SO3��g������ѧƽ��״̬�ı�־Ϊ__________��
2SO3��g������ѧƽ��״̬�ı�־Ϊ__________��
| A��SO2���ٵĻ�ѧ��Ӧ���ʺ�SO3���ٵĻ�ѧ��Ӧ������� |
| B�������������ƽ������������ʱ����仯 |
| C������������ķ�����������ʱ����仯 |
| D�����ݵ�������������ܶȲ���ʱ����仯 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com