
2g 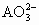 中,核外电子数比质子数多3.01×1022个,则元素A的相对原子质量为
中,核外电子数比质子数多3.01×1022个,则元素A的相对原子质量为
[ ]
科目:高中化学 来源: 题型:
 (2011?大兴区二模)短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,B的最外层电子数是次外层电子数的二倍,C最外层电子数是其电子层数的三倍,G与C同族且两元素核外电子总数之和与D、E两元素核外电子总数之和相等,F的最外电子数是次外层电子数的二分之一.
(2011?大兴区二模)短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,B的最外层电子数是次外层电子数的二倍,C最外层电子数是其电子层数的三倍,G与C同族且两元素核外电子总数之和与D、E两元素核外电子总数之和相等,F的最外电子数是次外层电子数的二分之一.

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10Be和9Be是中子数不同质子数相同的不同原子 | B、10Be的原子核内中子数比质子数多 | C、5.2g 26Al3+中所含的电子数约为6.02×1024 | D、26Al和26Mg的质子数、中子数和核外电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且A属于碱,B属于盐,组成元素的原子数目之比均为1:1:1,则化合物A的化学式为 ,B的化学式是 。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是 (填字母代号)。
A.+99.7kJ·mol-1 B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1 D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反
应生成Q单质的化学方程式 。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式 。
(4)X、Y两种元素形成的离子化合物的电子式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com