

| A. | Z2X是Cu2S、Z2Y是Cu2O | |
| B. | 步骤①发生的反应,其离子方程式可能为Cu2S+12H++10NO3ˉ=2Cu2++10NO2↑+SO42ˉ+6H2O | |
| C. | 步骤②发生的反应,其离子方程式为H++OHˉ=H2O、Cu2++2OHˉ=Cu(OH)2↓ | |
| D. | 步骤③发生的反应,说明葡萄糖具有氧化性 |
分析 元素X、Y是短周期同主族元素,元素Z是过渡元素,由图中蓝色溶液可知,Z为Cu,蓝色浊液应为Cu(OH)2,葡萄糖含-CHO,能被Cu(OH)2氧化,生成砖红色沉淀为Cu2O,则Y为O,可知X为S,以此来解答.
解答 解:由上述分析可知,X为S,Y为O,Z为Cu,
A.结合元素可知,Z2X是Cu2S、Z2Y是Cu2O,故A正确;
B.Cu2S与浓硝酸发生氧化还原反应,离子反应为Cu2S+12H++10NO3ˉ=2Cu2++10NO2↑+SO42ˉ+6H2O,遵循电子、电荷守恒,故B正确;
C.步骤②含过量硝酸、铜离子均与NaOH反应,则离子反应为H++OHˉ=H2O、Cu2++2OHˉ=Cu(OH)2↓,故C正确;
D.葡萄糖含-CHO,能被Cu(OH)2氧化,可知步骤③中说明葡萄糖具有还原性,故D错误;
故选D.
点评 本题考查无机物的推断,为高频考点,把握蓝色溶液、葡萄糖与氢氧化铜的反应为解答的关键,侧重分析与推断能力的考查,注意氧化还原反应的应用,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=1 的溶液中:NH+4、K+、ClO-、Cl- | |
| B. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| C. | 能与金属铝反应生成氢气的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 在含大量 Fe3+溶液中:NH4+、Na+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常情况下,镀锌铁的镀层损坏后,仍然可以保护铁不被腐蚀 | |
| B. | 电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 | |
| C. | 化学电池是将化学能变成电能的装置,它包括一次电池、二次电池和燃料电池等几大类 | |
| D. | 粗铜精炼的过程中,用纯铜板作阳极,粗铜板作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用药匙取用少量二氧化锰粉末 | |
| B. | 蒸馏实验中忘记加沸石,应先停止加热,待溶液冷却后加入沸石,继续蒸馏 | |
| C. | 用干燥洁净的玻璃棒蘸取84消毒液(主成分NaClO),点滴到干的pH试纸上测pH | |
| D. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度,从而增大与氢氧化钠溶液的接触面积,加快油脂皂化反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
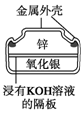 电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O+Zn+H2O═2Ag+Zn(OH)2,示意图如图.下列判断正确的是( )
电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O+Zn+H2O═2Ag+Zn(OH)2,示意图如图.下列判断正确的是( )| A. | 锌为负极,被还原 | |
| B. | 纽扣电池工作时,OHˉ移向Ag2O | |
| C. | 每6.5 g 锌发生反应时,转移电子0.1 NA | |
| D. | 纽扣电池工作时,电解质溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钒(V)广泛应用于航空、化工、能源等行业.
金属钒(V)广泛应用于航空、化工、能源等行业.| X | X | Y | Y | |
| 试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/K | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | SO2或SO3平衡转化率 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | |||
| Ⅰ | 723 | 0.2 | 0.1 | 0 | 0.16 | α1 |
| Ⅱ | 723 | 0.4 | 0.2 | 0 | α2 | |
| Ⅲ | 823 | 0 | 0 | 0.2 | α3 | |
| A. | 达到平衡时,α1+α3>1 | |
| B. | 达到平衡时,容器中的压强:PⅡ>PⅠ>PⅢ | |
| C. | 达到平衡时,容器Ⅲ中的逆反应速率比容器Ⅰ中的大 | |
| D. | 若起始时,向容器Ⅰ中充入0.16 mol SO2、0.04 mol O2和0.16 mol SO3,则此时反应向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | 乙醇 (乙酸) | CaO | 蒸馏 |
| B | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | CH3CH2Br(Br2) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com