
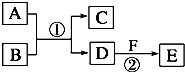
 (A、B、C、D、E、F六种物质的转化关系如图(反应条件和部分产物未标出).
(A、B、C、D、E、F六种物质的转化关系如图(反应条件和部分产物未标出).

科目:高中化学 来源: 题型:
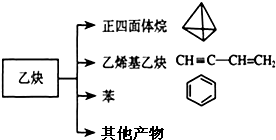 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都会水解 |
| B、丁烷(C4H10)和二氯甲烷都存在同分异构体 |
| C、只用新制的Cu(OH)2悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液 |
| D、汽油、柴油、植物油都是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主食 | 米饭 |
| 副食 | 土豆、白菜、萝卜汤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
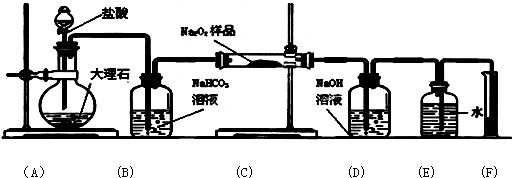
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、多数合金的熔点一般比其各成分金属的熔点低 |
| B、多数合金的硬度一般比其各成分金属的硬度小 |
| C、合金的物理性质一般与其各成分金属的物理性质不同 |
| D、合金的化学性质一般与其各成分金属的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com