
| A. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw变小 | |
| C. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
分析 A.溶液中存在离子积常数,稀释溶液氢离子浓度减小,氢氧根离子浓度增大;
B.水的离子积常数随温度变化;
C.反应自发进行的判断依据是△H-T△S<0分析;
D.沉淀转化,当离子浓度积大于溶度积,离子结合向形成沉淀分析进行.
解答 解:A.溶液中存在离子积常数,稀释溶液氢离子浓度减小,氢氧根离子浓度增大,故A错误;
B.水的离子积常数随温度变化,温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变,故B错误;
C.反应自发进行的判断依据是△H-T△S<0分析,一定温度下,反应2NO(g)+O2(g)═2NO2(g)能够自发进行,△H-T△S<0,反应前后气体体积减小,△S<0,则△H<0,故C正确;
D.沉淀转化,当离子浓度大于溶度积,离子结合向形成沉淀分析进行,可能使BaSO4沉淀转化为BaCO3沉淀,故D错误;
故选C.
点评 本题考查较为综合,涉及弱电解质的电离、自发进行的判断、难溶物溶解平衡等知识,题目难度中等,明确难溶物溶解平衡、弱电解质的电离平衡及其影响为解答关键,注意掌握反应能够自发进行的条件,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2 SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体不能缺碘,需要正常补碘.“加碘食盐”中的“碘”是指碘元素 | |
| B. | 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝 | |
| C. | “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物 | |
| D. | 水壶中产生的水垢可用食醋清洗除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 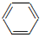 +HO-Na2$→_{60℃}^{浓硫酸}$ +HO-Na2$→_{60℃}^{浓硫酸}$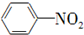 +H2O +H2O | |
| C. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | |
| D. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 着色剂---胡萝卜素、苯甲酸钠 | B. | 调味剂---亚硝酸钠、味精 | ||
| C. | 防腐剂---氯化钠、柠檬黄 | D. | 营养强化剂---酱油中加铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
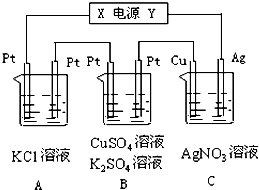 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
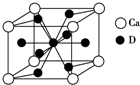 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com