
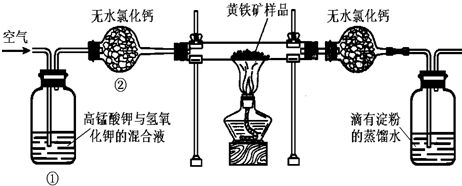
| 1.225×10 -3mol×32g/mol |
| 0.09g |


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).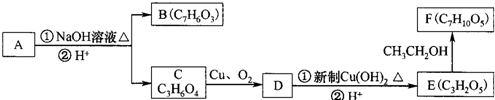
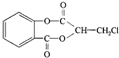
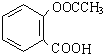 (即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有
(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 )经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
)经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH | 浓H2SO4 |
| 170℃ |
| H2 |
| 催化剂/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
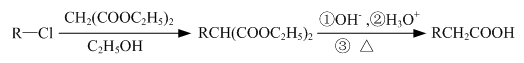
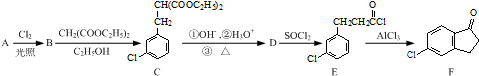
 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: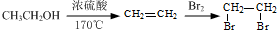
查看答案和解析>>
科目:高中化学 来源: 题型:
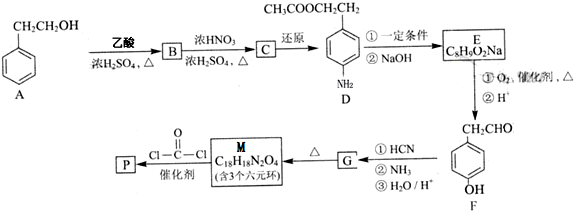
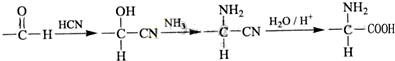
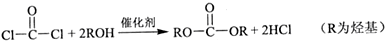
查看答案和解析>>
科目:高中化学 来源: 题型:
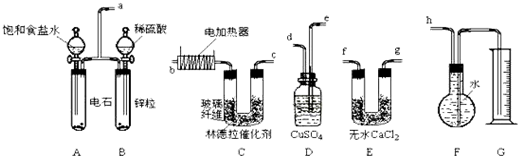
查看答案和解析>>
科目:高中化学 来源: 题型:

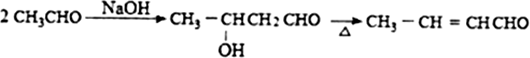
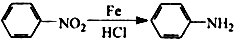 :苯胺中氨基易被氧化.
:苯胺中氨基易被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、误食重金属盐可立即服用大量的牛奶或豆浆解毒 |
| B、对生活中的塑料垃圾进行填埋,可防止“白色污染” |
| C、食用含铁丰富的食物,可改善贫血症状 |
| D、将碗筷高温蒸煮,可杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b=c |
| B、a>b>c |
| C、a>c>b |
| D、c>a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com