
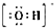 .
.
分析 (1)(2)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,考虑为10电子微粒,通常状况下,W为无色液体判断为H2O;X有5个原子核,发生反应X+Y$\stackrel{△}{→}$Z+W,饮食NH4++OH-=NH3↑+H2O,推断X为NH4+、Y为OH-、Z为NH3;
(3)装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮;
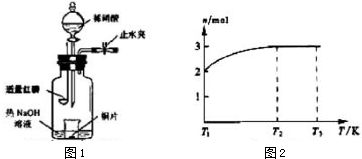
(4)①温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2;
②温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,根据起始加入1molN2O4计算混合气体总质量,计算混合气体的平均摩尔质量确定平均相对分子质量.
解答 解:(1)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,考虑为10电子微粒,通常状况下,W为无色液体判断为H2O;X有5个原子核,发生反应X+Y$\stackrel{△}{→}$Z+W,饮食NH4++OH-=NH3↑+H2O,推断X为NH4+、Y为OH-、Z为NH3,Y的电子式为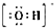 ,
,
故答案为: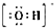 ;
;
(2)液态Z为NH3与W为H2O的电离相似,都可电离出电子数相同的两种离子,液态NH3的电离方程式是2NH3(l)?NH2-+NH4+,
,故答案为:2NH3(l)?NH2-+NH4+;
(3)装置用来制备NO并验证其还原性,先制备无氧气操作状态下制得的NO,为了更好的验证一氧化氮气体的还原性,白磷燃烧消耗掉氧气,氢氧化钠吸收空气中的二氧化碳和生成的五氧化二磷,再滴入硝酸和铜反应生成一氧化氮无色气体;验证一氧化氮的还原性可以打开止水夹使空气进入到广口瓶,一氧化氮遇到氧气会被氧化为二氧化氮,
①由上述分析可知,步骤c后还缺少的一步主要操作是:打开止水夹,通入少量氧气,
故答案为:打开止水夹,通入少量氧气;
②红磷充分燃烧的产物为P2O5,与NaOH溶液反应的离子方程式是P2O5+6OH-=2PO43-+3H2O,
故答案为:P2O5+6OH-=2PO43-+3H2O;
③步骤c滴入稀硝酸后烧杯中,发生反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,现象是:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色,
故答案为:Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)①温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2,方程式为:2NO2?2NO+O2,
故答案为:2NO2?2NO+O2;
②温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,起始加入1molN2O4,故平衡混合气体总质量=1mol×92g/mol=92g,混合气体的平均摩尔质量=$\frac{92g}{3mol}$=30.7g/mol,故混合气体的平均相对分子质量为30.7,
故答案为:30.7.
点评 本题考查无机物推断、化学实验、化学平衡等,注意一氧化氮的制备应在没有氧气条件下进行,(4)中方程式的书写为易错点,学生容易认为NO2转化为N2O4,忽略混合气体物质的量增大,题目难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 +Br2$\stackrel{催化剂}{→}$
+Br2$\stackrel{催化剂}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuCl2(无水CuSO4) | B. | NaOH(H2O) | C. | NaCl(HCl气体) | D. | CuSO4(Cu(OH)2固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、低压 | B. | 低温、高压 | C. | 低温、低压 | D. | 高温、高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
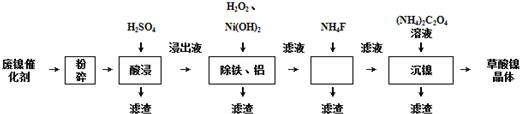
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com