
| 甲 | K2SO4、BaCl2、NH4NO3 |
| 乙 | NaCl、Ca(OH)2、K2CO3 |
| 丙 | HCl、Na2SO4、NaCl |
| 丁 | K2SO4、Na NO3、KCl |
| A、甲 | B、乙 | C、丙 | D、丁 |


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
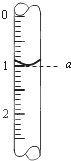 滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.
滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的相对强弱 |
| C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2 1mol I2 | 2mol HI | 4mol HI |
| HI的浓度 | c1 | c2 | c3 |
| 反应的能量变化 | 放出akg | 吸收bkg | 吸收ckg |
| 反应物转化率 | α1 | α2 | α3 |
| A、2α1=α3 |
| B、α1+α2=1 |
| C、c1=c2=c3 |
| D、a+b=14.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋除去暖水瓶中的水垢,水垢溶解,有无色气泡产生:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O |
| C、向NaHCO3和CaCl2混合溶液中,加入少量NaOH溶液:OH-+HCO32-═CO32-+H2O |
| D、用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列实验操作中,错误的是
(1)下列实验操作中,错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com