
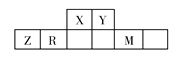
【题目】有五种短周期主族元素,它们在周期表中的位置如图所示,已知R元素的最高正化合价与最低负化合价的代数和为0。
完成下列问题:
(1)Z元素在周期表中的位置是__________________,同周期原子半径最大的元素是____________(填元素符号)。
(2)X的简单氢化物与M的单质,在一定条件下可以发生置换反应,化学方程式为______________,还原产物中含有的化学键类型有____________。
(3)我国发射“神舟”系列飞船的长征火箭,常以X、Y的液态氢化物做燃料。已知X、Y的两种氢化物电子数相等,并且反应时生成两种无毒、无污染的物质。
①写出两种氢化物反应的化学方程式____________________________,反应中氧化剂和还原剂的物质的量之比为____________。
②X的液态氢化物的电子式__________________。
(4)下列说法能证明R、Y非金属性强弱的是____________。
A.R和Y的单质在一定条件下能生成RY2
B.Y单质常温下是气体,R单质是固体
C.Y的氢化物稳定性大于R的氢化物
D.自然界中存在Y单质不存在R单质
【答案】 第三周期、第IIIA族 Na 8NH3+3Cl2![]() N2+6NH4Cl 离子键、共价键 N2H4+2H2O2
N2+6NH4Cl 离子键、共价键 N2H4+2H2O2![]() N2+4H2O 2∶1
N2+4H2O 2∶1 ![]() C
C
【解析】有五种短周期主族元素,它们在周期表中的位置如图所示,已知R元素的最高正化合价与最低负化合价的代数和为0,则R为硅,再由表 确定X为N,Y为O,Z为Al,M为Cl。
确定X为N,Y为O,Z为Al,M为Cl。
(1)Z为Al元素在周期表中的位置是第三周期、第IIIA族,同周期原子半径从左到右,由大到小,故同周期原子半径最大的元素是Na(填元素符号)。(2)X的简单氢化物是氨气,与Cl2的单质,在一定条件下可以发生置换反应,氯气具有强氧化性,化学方程式为8NH3+3Cl2![]() N2+6NH4Cl,还原产物NH4Cl中含有的化学键类型有离子键、共价键。
N2+6NH4Cl,还原产物NH4Cl中含有的化学键类型有离子键、共价键。
(3)我国发射“神舟”系列飞船的长征火箭,常以X、Y的液态氢化物做燃料。已知X、Y的两种氢化物电子数相等,两种氢化物分别是N2H4,H2O2,并且反应时生成两种无毒、无污染的物质,N2和H2O。①两种氢化物反应的化学方程式 N2H4+2H2O2![]() N2+4H2O,氧化剂H2O2,还原剂为 N2H4,氧化剂和还原剂的物质的量之比为2:1。②X的液态氢化物的电子式
N2+4H2O,氧化剂H2O2,还原剂为 N2H4,氧化剂和还原剂的物质的量之比为2:1。②X的液态氢化物的电子式![]() 。(4)A、R和Y的单质在一定条件下能生成RY2,并不能说明R和Y哪个是氧化剂,故A错误;B、Y单质常温下是气体,R单质是固体,下金属性没有必然联系,故 B错误;C.Y的氢化物稳定性大于R的氢化物,元素的非金属性越强,气态氢化物越稳定,故C正确;D、自然界中存在Y单质不存在R单质,只能说明两种元素的存在形态,故D错误;故选C。
。(4)A、R和Y的单质在一定条件下能生成RY2,并不能说明R和Y哪个是氧化剂,故A错误;B、Y单质常温下是气体,R单质是固体,下金属性没有必然联系,故 B错误;C.Y的氢化物稳定性大于R的氢化物,元素的非金属性越强,气态氢化物越稳定,故C正确;D、自然界中存在Y单质不存在R单质,只能说明两种元素的存在形态,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是____,非金属性最强的元素是____。
(2)化学性质最不活泼的元素是____,其原子结构示意图为__________。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是______________________________。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是___________________
(5)在③④⑥三种元素中,离子半径由大到小的顺序是___________________。
(6)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是___________________。
(7)请设计实验证明⑦原子得电子能力比⑥原子强_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的工业废水中可能含有K+、H+、Mg2+、SO42—、Cl—、NO3— 离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A. H+、K+、NO3— B. K+、NO3—、SO42—
C. H+、Mg2+ D. K+、Mg2+、SO42—、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可划分为一次能源和二次能源,直接从自然界取得的能源称为一次能源,一次能源经过加工、转换得到的能源称为二次能源。下列能源中属于一次能源的是( )
A.氢能B.电能C.核燃料D.水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q、m、n分别为常见的气体单质,p和s均为有色气体,q能在p中燃烧并产生苍白色火焰,v的水溶液呈碱性,t的水溶液呈酸性。回答下列问题:
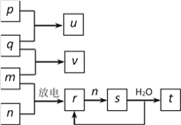
(1)新制p的水溶液中,除H2O、H+、OH-外,还含有____________等粒子(填化学式)
(2)取2份新制p的水溶液,向第一份中滴入紫色石蕊溶液,现象是____________;第二份先滴入FeCl2溶液,后加入KSCN溶液,其现象是_____________,有关反应的离子方程式为_______________、_________________。
(3)反应“v+n→r”的化学方程式是__________,每转移2 mol电子,可生成标准状况下的r气体________L。s溶于水的反应中,氧化剂与还原剂的物质的量之比为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业中,作为催化剂的V2O5对反应Ⅰ的催化过程经历了Ⅱ、Ⅲ两个反应阶段,如图1: 
(1)下列分子中1mol化学键断裂时需要吸收的能量数据如表:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
则反应I的△H=kJ/mol.反应Ⅲ的化学方程式为 .
(2)从废钒催化剂中回收V2O5的过程如图2: 
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式 .
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为[25℃,Ksp(NH4VO3)=1.6×10﹣3 , 溶液体积变化忽略不计].
(3)采用脱硫脱硝技术,同时吸收SO2和NOx , 获得(NH4)2SO4的稀溶液. ①向此溶液稀溶液中再加入少量(NH4)2SO4固体, ![]() 将(填“变大”、“不变”或“变小”).
将(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 ![]() =(用含a的代数式表示,NH3H2O的Kb=1.7×10﹣5)
=(用含a的代数式表示,NH3H2O的Kb=1.7×10﹣5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于2 mol O2 下列说法不正确的是( )
A. 含有2NA个氧分子 B. 含有2mol氧原子
C. 质量为64g D. 标况下体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能完成相应实验的是( )
A. 如图用于证明非金属性强弱:Cl>C>S
如图用于证明非金属性强弱:Cl>C>S
B. 如图用于分离I2和NH4Cl
如图用于分离I2和NH4Cl
C. 如图用于测定某NaOH溶液的浓度
如图用于测定某NaOH溶液的浓度
D.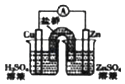 如装置能组成Cu﹣Zn原电池
如装置能组成Cu﹣Zn原电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com